Titanium
Inhoudsopgave
Titanium is vernoemd naar de Titanen, de Griekse mythologische goden. Het is het 22ste element in het periodiek systeem. Titanium wordt toegepast in vliegtuigen, piercings, medische apparatuur en zelfs in zonnebrandcrème.
Titanium is corrosiebestendig en bijzonder sterk en licht van gewicht. Het is net zo sterk als staal maar weegt slechts 45% van staal. Het is twee keer zo sterk als aluminium maar slechts 60% zwaarder.
Chemische gegevens
| Symbool | Ti |
| Volledige naam | Titanium |
| Atoomnummer | 22 |
| Atoommassa (g.mol-1 ) | 47,867 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 1,54 |
| Dichtheid (g.cm-3 bij 20 °C) | 4,506 |
| Smeltpunt (°C) | 1668 |
| Kookpunt (°C) | 3287 |
| Vanderwaalsstraal (nm) | 0,147 |
| Ionstraal | 0,09 (+2); 0,068 (+4) |
| Isotopen | 5 stabiele isotopen |
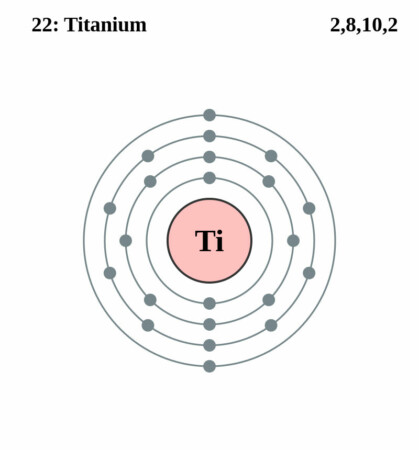
| Elektronenschil | [Ar]3d2 4s2 |
| Elektronen per schil | 2, 8, 10, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 658,8 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1309,8 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2652,5 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1791 door William Gregor |
Voor een element met superkrachten heeft titanium een passend scheppingsverhaal: het element wordt gemaakt tijdens supernova-explosies. Men heeft berekent dat supernova 1987A 100 aardmassa’s aan titanium-44 kan produceren. Titanium-44 is een radioactief isotoop.
Titanium is het negende meest voorkomende element in de korst van de Aarde maar het werd pas in 1791 ontdekt. De Engelse amateurgeoloog William Gregor ontdekte wat zwart, metaalachtig zand in een kreekbedding. Hij analyseerde het en ontdekte dat het een mengsel was van magnetiet, een veel voorkomende vorm van ijzeroxide, en een nieuw metaal. Gregor noemde het manaccaniet naar de parochie waar hij het zand had gevonden.
Vier jaar later bestudeerde de Duitse chemicus Martin Heinrich Klaproth een erts uit Hongarije toen hij zich realiseerde dat het een nooit eerder beschreven chemisch element bevatte. Hij noemde het titanium en later bevestigde hij dat het manaccaniet van Gregor ook titanium bevatte.
M.A. Hunter, werkzaam bij General Electric was de eerste die titanium in zuivere vorm wist te maken maar het duurde tot de jaren ’30 voor er een commercieel toepasbaar procedure werd ontwikkeld. Het was William J. Kroll die een industrieel toepasbaar proces uitvond. Dir Kroll-procedé behandelt titaniumoxide met chloor waarbij er titaniumchloride ontstaat. Hierna wordt in een argon-milieu natrium of magnesium met titaanoxide gemengd (zuurstof toelaten zou leiden tot een explosieve reactie). Bij een tempratuur van 1200 °C reduceert magnesium of natrium titaniumchloride tot zuiver titaan. Dit proces is ongeveer 1000 maal minder efficiënt dan het proces dat gebruikt wordt om ijzer te maken. Dit is een verklaring waarom titanium het duurdere metaal is.
Titaan is een transitiemetaal en dat betekent dat het bindingen kan aangaan met behulp van elektronen uit zijn buitenste schillen of energieniveaus. Het deelt deze functie met andere transitiemetalen waaronder goud, koper en kwik.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 22 | Titanium | 46 Ti | 45,952629 | 8,25 |
| 47 Ti | 46,951764 | 7,44 | ||
| 48 Ti | 47,947947 | 73,72 | ||
| 49 Ti | 48,947871 | 5,41 | ||
| 50 Ti | 49,944792 | 5,18 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 38Ti | 38,00977 | < 120 ns |
| 39Ti | 39,00161 | 31 ms |
| 40Ti | 39,99050 | 53,3 ms |
| 41Ti | 40,98315 | 80,4 ms |
| 42Ti | 41,97303 | 199 ms |
| 43Ti | 42,96852 | 509 ms |
| 44Ti | 43,95969 | 60,0 jaar |
| 45Ti | 44,95812 | 184,8 min |
| 51Ti | 50,94661 | 5,76 min |
| 52Ti | 51,94689 | 1,7 min |
| 53Ti | 52,94973 | 32,7 s |
| 54Ti | 53,95105 | 1,5 s |
| 55Ti | 54,95527 | 490 ms |
| 56Ti | 55,95820 | 164 ms |
| 57Ti | 56,96399 | 60 ms |
| 58Ti | 57,96697 | 54 ms |
| 59Ti | 58,97293 | 30 ms |
| 60Ti | 59,97676 | 22 ms |
| 61Ti | 60,98320 | 10 ms |
| 62Ti | 61,98749 | 10 ms |
| 63Ti | 62,99442 | 3 ms |
Bohr – Rutherford diagram
Weetjes
- Bijna alle stollingsgesteentes bevatten titanium.
- Een Boeing 737 Dreamliner bevat 15% titanium.
- Titanium draait ook om de Aarde: het International Space Station bevat verschillende titanium onderdelen. Het Rosetta Project, met als doel het archiveren van menselijke talen, heeft een stuk geëtst zuiver titanium buiten het ISS laten vliegen om te zien of het bestand is tegen straling uit de ruimte.
- De Aarde is niet de plek waar titanium is gevonden. In 2011 toonde een satelliet-kaart van de Maan aan dat ook daar titaniumrijk gesteente voorkomt. Dit gesteente bevat vaak tot 10% titanium en dat is veel meer dan de ongeveer 1% die vaak in aards gesteente wordt aangetroffen.
- Titanium kant gebruikt worden om er 3Dprints mee te maken. Zo werden er bijvoorbeeld ooit lichtgewicht hoefijzers voor racepaarden mee geprint.
Titaniumoxide
Titaniumdioxide (TiO2), ook titanium(IV)oxide genoemd, is de in de natuur voorkomende oxide van titaan. Titaniumdioxide is een wit pigment dat wordt gebruikt in verven (als titaniumwit of pigmentwit 6) en zonnebrandcrème. Titaniumdioxide heeft namelijk het vermogen om licht te breken en ultraviolette straling te absorberen. Ongeveer 95% van de gedolven titanium wordt omgezet in titaniumoxidepigmenten. De overige 5% wordt gebruikt voor de productie van chemicaliën, metaal, carbiden en coatings.
Titaandioxide wordt ook vaak gebruikt in de farmacie, cosmetica en tandpasta’s. het wordt in toenemende mate als voedingsadditief (E171) gebruikt om producten witter te maken of ze er ondoorzichtiger uit te laten zien. Enkele van de meest voorkomende voedingsproducten met toegevoegd E171 zijn glazuur, kauwgom en supplementen.
Er zijn geen beperkingen voor het gebruik van titaandioxide in voedingsproducten. Echter studies met muizen hebben aangetoond dat titaandioxide-deeltjes zeer schadelijk kunnen zijn voor mensen met bepaalde darmafwijkingen. Onderzoekers ontdekten dat wanneer darmcellen titaandioxidedeeltjes absorberen het darmslijmvlies van muizen met colitis ontstoken en beschadigd raakte.
Darmaandoeningen zoals de ziekte van Crohn en colitis ulcerosa nemen in de westerse wereld al vele jaren toe. Deze aandoeningen worden gekenmerkt door een extreme auto-immuunreactie op de darmflora. Bij het ontstaan van deze ziektes spelen verschillende factoren een rol waaronder genetica en omgevingsfactoren zoals levensstijl en voeding. Onderzoekers hebben ontdekt dat nano-deeltjes titaniumdioxide, die vaak worden aangetroffen in tandpasta en veel voedingsmiddelen, deze ontstekingsreacties nog kunnen verergeren.
Bovendien zijn er grote hoeveelheden titaandioxide-deeltjes gevonden in het bloed van patiënten met colitis ulcerosa. Dit betekent dat deze deeltjes onder bepaalde omstandigheden uit het voedsel kunnen worden opgenomen. Hoewel de bevindingen nog niet zijn bevestigd suggereren onderzoekers dat patiënten met colitis ulcerosa de opname van titaniumdioxide-deeltjes moeten vermijden.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30