Kwik
Inhoudsopgave
In zijn glanzende, snel bewegende vloeibare vorm ziet kwik er mooi uit maar raak het niet aan! Het kan zeer giftig zijn voor mensen.
Het atoomsymbool Hg komt van het Griekse “hydrargyrum” en dat betekent “vloeibaar zilver”. Vanwege zijn vloeibaarheid staat het ook bekend als kwikzilver. Het is vernoemd naar de snelst bewegende planeet in ons zonnestelsel. Kwik is al eeuwen bekend bij de mensheid. Er zijn bewijzen gevonden voor het gebruik ervan in China, India en Egypte en er zijn sporen van kwik gevonden in 3500 jaar oude Egyptische graven.
Kwik is een erg giftig element. Het kan het lichaam binnendringen via een open wond of door het in te ademen. Het kan dan schade aanrichten aan de zenuwen, lever en nieren. Daarnaast kunnen er nog andere symptomen optreden.
Ondanks zijn giftige eigenschappen kan kwik nog steeds nuttig zijn voor ons. Het element geleidt elektriciteit en het wordt daarom wel gebruikt in elektrische schakelaars van thermostaten en bepaalde soorten alarmklokken. Kwik is voor de meesten het best zichtbaar in fluorescentielampen (TL en spaarlampen) waar kwikdamp een van de gebruikte chemicaliën is.
Vanwege de hoge dichtheid wordt kwik gebruikt in thermometers, barometers en andere wetenschappelijke instrumenten. Om veiligheidsredenen is het gebruik van kwik in thermometers en barometers voor consumenten in Nederland verboden.
Chemische gegevens
| Symbool | Hg |
| Volledige naam | Kwik |
| Atoomnummer | 80 |
| Atoommassa (g.mol-1 ) | 200,59 |
| Groep | transitie metaal |
| Elektronegativiteit (Pauling) | 2,00 |
| Dichtheid (g.cm-3 bij 20 °C) | 13,5336 |
| Smeltpunt (°C) | -38,83 |
| Kookpunt (°C) | 356,73 |
| Vanderwaalsstraal (nm) | 0,155 |
| Ionstraal (nm) | 0,11 (+2) |
| Isotopen | 7 stabiele isotopen |
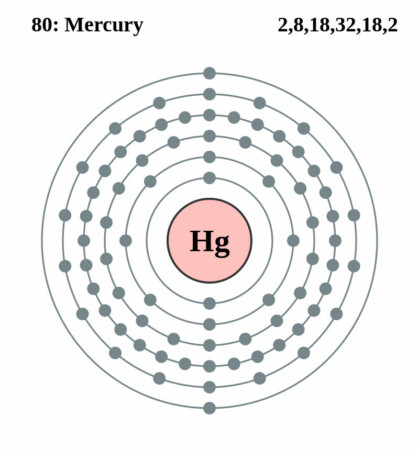
| Elektronenschil | [Xe]4f145d106d2 |
| Elektronen per schil | 2, 8, 18, 32, 18, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1007,1 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1810 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3300 |
| Standaard potentiaal (V) | +0,854 (Hg2+/Hg) |
| Ontdekt door: | vóór 1500 v. Christus door de oude Egyptenaren |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 80 | Kwik | 196 Hg | 195,965815 | 0,15 |
| 198 Hg | 197,966752 | 9,97 | ||
| 199 Hg | 198,968262 | 16,87 | ||
| 200 Hg | 199,968309 | 23,10 | ||
| 201 Hg | 200,970285 | 13,18 | ||
| 202 Hg | 201,970626 | 29,86 | ||
| 204 Hg | 203,973476 | 6,87 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 173Hg | 172,99724 | 1,1 ms |
| 174Hg | 173,99286 | 2,0 ms |
| 175Hg | 174,99142 | 10,8 ms |
| 176Hg | 175,98735 | 20,4 ms |
| 177Hg | 176,98628 | 127,3 ms |
| 178Hg | 177,98248 | 0,269 s |
| 179Hg | 178,98183 | 1,09 s |
| 180Hg | 179,97826 | 2,58 s |
| 181Hg | 180,97781 | 3,6 s |
| 182Hg | 181,97469 | 10,83 s |
| 183Hg | 182,97445 | 9,4 s |
| 184Hg | 183,97171 | 30,6 s |
| 185Hg | 184,97189 | 49,1 s |
| 186Hg | 185,96936 | 1,38 min |
| 187Hg | 186,96981 | 1,9 min |
| 188Hg | 187,96757 | 3,25 min |
| 189Hg | 188,96819 | 7,6 min |
| 190Hg | 189,96632 | 20,0 min |
| 191Hg | 190,96715 | 49 min |
| 192Hg | 191,96563 | 4,85 uur |
| 193Hg | 192,96666 | 3,80 uur |
| 194Hg | 193,96543 | 444 jaar |
| 195Hg | 194,96672 | 10,53 uur |
| 197Hg | 196,96721 | 64,14 uur |
| 203Hg | 202,97287 | 46,595 dagen |
| 205Hg | 204,97607 | 5,14 min |
| 206Hg | 205,97751 | 8,15 min |
| 207Hg | 206,98259 | 2,9 min |
| 208Hg | 207,98594 | 42 min |
| 209Hg | 208,99104 | 37 s |
| 210Hg | 209,99451 | 10 min |
Bohr – Rutherford diagram
Extraheren van goud
Kwik wordt meestal aangetroffen in de vorm van kwiksulfiet, zijn gewone erts. Kwik komt zelden in zuivere vorm voor. Om zuiver kwik te extraheren wordt het erts vermalen en verwarmd tot een temperatuur van ongeveer 580 °C met de daarbij aanwezige zuurstof. Kwikdamp ontsnapt uit de ertsen en er komt ook zwaveldioxide (SO2) vrij. Het metaal wordt gecondenseerd en gewassen met salpeterzuur (HNO3) om het te zuiveren en vervolgens wordt het gedestilleerd.
Kwik kan legeringen vormen met goud, zilver, zink en cadmium. Deze legeringen worden amalgamen genoemd, Door die amalgamen kan kwik worden gebruikt om goud uit gesteente te winnen. Als kwik in contact komt met goud lost het goud op in het kwik en worden de twee door middel van destillatie weer gescheiden.
Kwik kan ook verbindingen vormen met andere elementen. Een van die verbindingen, kwiknitraat, speelde een belangrijke rol bij de term “zo gek als een hoedenmaker”.
Kwik werd gebruikt bij het maken van hoeden van dierenhuiden. In de 18de eeuw gebruikte men kwiknitraat om de pelzen schoon te maken voordat ze tot hoeden werden verwerkt.
Men ontdekte dat een groot deel van de mensen die met kwiknitraat werkten uiteindelijk een hersenbeschadiging opliepen. De term “zo gek als een hoedenmaker” komt dus eigenlijk door de blootstelling aan kwik.
Andere veel voorkomende kwikverbindingen zijn onder meer kwikchloride (HgCl2). Dit is een zeer giftig zout dat ooit werd gebruikt al wonddesinfectiemiddel. Een ander voorbeeld is kwikchloride maar dan in de vorm van Hg2Cl2. Deze verbinding is beter bekend als kalomel, een antisepticum dat wordt gebruikt om bacteriën te doden. Kwiksulfide (HgS) wordt gebruikt om een rood verfpigment genaamd vermiljoen te maken. Kwikoxide (HgO) wordt gebruikt in kwikbatterijen.
Weetjes
- Paleolithische schilders gebruikten 30.000 jaar geleden vermiljoen om de grotten in Spanje en Frankrijk te versieren.
- Alchemisten dachten vroeger dat kwik in combinatie met andere metalen in goud kon worden omgezet.
- Tot het begin van de 20ste eeuw was kwik het belangrijkste behandelingsmiddel voor syfilis. Het werd gebruikt in de vorm van pillen, kalomel, zalven en stoombaden. De bijwerkingen van deze giftige behandelingen waren onder andere tandverlies, zweren, neurologische schade en zelfs de dood.
- Kwik is 13,6 keer zwaarder dan hetzelfde volume water.
- Ko-Hung, een belangrijke Chinese alchemist uit de vierde eeuw, probeerde kwik op de voeten van mensen te smeren. Hij geloofde namelijk dat ze hierdoor over water konden lopen. Hij plaatste het ook over een drempel om dieven weg te houden en hij probeerde het zelfs met frambozensap te combineren in de hoop dat het oudere mannen zou helpen om kinderen te verwekken.
- De korst van de Aarde bestaat voor ongeveer 0,5 ppm uit kwik. Het is daarmee schaarser dan uranium maar het komt meer voor dan goud of zilver.
- De Romeinen exploiteerden kwikmijnen als strafinrichtingen voor criminelen en slaven. Zoals te verwachten was de levensduur van de gevangen kort vanwege de grote kans op vergiftiging.
- Kwik is het enige metaal dat bij kamertemperatuur vloeibaar is.