Natrium
Inhoudsopgave
Wat is Natrium?
Natrium (atoomnummer 11 en symbool Na) is een metaal en een chemisch element dat in 1807 werd ontdekt door de Engelse uitvinder en chemicus Humphrey Davy. Het komt voor in natriumzouten en mineralen zoals veldspaat, steenzout en sodaliet.
Chemische gegevens
| Symbool | Na |
| Volledige naam | Natrium |
| Atoomnummer | 11 |
| Atoommassa (g.mol-1 ) | 22,9898 |
| Groep | Alkalimetalen |
| Elektronegativiteit (Pauling) | 0,9 |
| Dichtheid (g.cm-3 bij 20 °C) | 0,97 |
| Smeltpunt (°C) | 97,5 |
| Kookpunt (°C) | 883 |
| Vanderwaalstraal (nm) | 0,196 |
| Ionstraal (nm) | 0,095 (+1) |
| Isotopen | 1 |
| Elektronenconfiguratie | [Ne]3s1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 495,7 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 4562 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 6910 |
| Standaard potentiaal (V) | -2,71 |
| Ontdekt door | Humphrey Davy in 1807 |
Bohr-Rutherford diagram
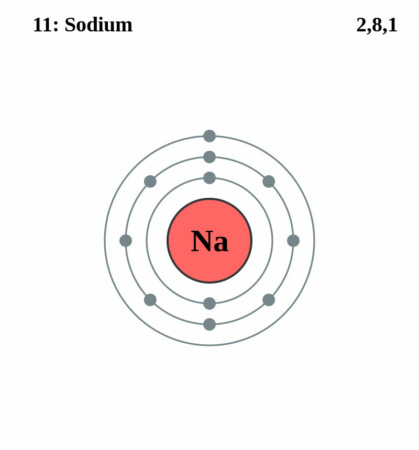
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 11 | Natrium | 23 Na | 22,989770 | 100 |
Radioisotopen
| Symbool | Atoommasa (u) | Halfwaardetijd |
|---|---|---|
| 18 Na | 18,02597 | 1,3 × 10−21 s |
| 19 Na | 19,013877 | < 40 ns |
| 20 Na | 20,007351 | 447,9 ms |
| 21 Na | 20,9976552 | 22,49 s |
| 22 Na | 21,9944364 | 2,6027 jaar |
| 24 Na | 23,99096278 | 14,9590 uur |
| 25 Na | 24,9899540 | 59,1 s |
| 26 Na | 25,992633 | 1,077 s |
| 27 Na | 26,994077 | 301 ms |
| 28 Na | 27,998938 | 30,5 ms |
| 29 Na | 29,002861 | 44,9 ms |
| 30 Na | 30,008976 | 48,4 ms |
| 31 Na | 31,01359 | 17,0 ms |
| 32 Na | 32,02047 | 12,9 ms |
| 33 Na | 33,02672 | 8,2 ms |
| 34 Na | 34,03517 | 5,5 ms |
| 35 Na | 35,04249 | 1,5 ms |
| 36 Na | 36,05148 | < 260 ns |
| 37 Na | 37,05934 | 1 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Eigenschappen
Natrium is een metaal met een relatief laag smeltpunt. Het is reactief en zacht. Het is een goede elektrische geleider en het heeft een zilverachtige kleur. Natrium heeft drie isotopen en het komt voor in verschillende verbindingen zoals carbonaten, nitraten, sulfaten en halogenides. Natrium vormt ook organonatriumverbindingen. Het element reageert met metaalhalogenides, waterstof ammonia en water. Als het met ijs, sneeuw en water reageert dan ontstaat er waterstof en natriumhydroxide.
Toepassingen
Er zijn verschillende commerciële toepassingen waar natrium bij gebruikt wordt: de productie van trifenylfosfine, indigo, natriumazide en voorhydride. Azide wordt bijvoorbeeld gebruikt voor anorganische en organische synthese en voor de productie van airbags van auto’s en ontsnappingsglijbanen van vliegtuigen. Het is ook een biocide en conserveermiddel en het remt de groei van grampositieve en gramnegatieve bacteriën. Het element wordt ook toegevoegd aan legeringen en gebruikt om gesmolten metalen te verwerken en om metalen te ontkalken. Het wordt ook gebruikt om natriumlampen en zepen te produceren. Natriumcarbonaat is een additief dat wordt gebruikt als stabilisator, rijsmiddel en antiklontermiddel. Het heeft ook andere toepassingen en wordt gebruikt in de katoen- en baksteenindustrie. Natriumcarbonaat wordt gebruikt voor de behandeling van katoenzaad, het extraheren van klei en het vormen van verbindingen zoals zink-, aluminium- en ijzer(II)carbonaat. Natrium wordt ook gebruikt voor verschillende testen zoals de natriumfusietest en de Birch-reductie die in 1944 door de Australische chemicus Arthur Birch werd bedacht. Natriumcarbonaat wordt gebruikt om water te zuiveren terwijl natriumhydroxide wordt gebruikt om verstoppingen te verwijderen. Natriumwaterstofcarbonaat wordt gebruikt voor de productie van reinigingsmiddelen en zepen en in de leer- en kledingindustrie.
Voorkomen, gezondheid & gevaren
Natrium wordt in de natuur gevonden in de vorm van zouten zoals natriumsulfaat, nitraat, boraat, carbonaat en chloride. Het komt voor in bronwater, alkalische en zoutmeren en in zeewater. Natrium is belangrijk voor een goede voeding en goed functioneren van spieren en zenuwen. Echter, een inname van teveel natrium kan leiden tot verhoogde bloeddruk en nierproblemen. Etenswaren met een hoog natriumgehalte zijn onder andere bacon, dressings, zoetzuur, kaas, gezouten noten en kant-en-klare soepen. Een tekort aan natrium leidt onder andere tot spierkrampen en spasmen, vermoeidheid, verwarring en stofwisselingsproblemen. Natrium is ook belangrijk voor planten en andere levende organismes. Het speelt een rol in de synthese van chlorofyl en de stofwisseling.
Er zijn ook gezondheidsrisico’s. Als natrium reageert met water kan kunnen de dampen leiden tot neus- keel- huid- en oogirritatie. Ook veroorzaken de dampen niezen en hoesten. Elementair natrium moet voorzichtig worden behandeld want het vormt een hydroxide die basisch is. Natrium reageert met oxides, zure oxides en zuren.
Tegelijkertijd heeft natriumhydroxide vele toepassingen. Natrium komt in de natuur voor in de vorm van zouten zoals natriumsulfaat, -nitraat, -boraat, -carbonaat en natriumchloride. Natrium is ook belangrijk voor een goede voeding en een goede werking van spieren en zenuwen. Overmatige natriuminname kan echter leiden tot hoge bloeddruk en nierproblemen. Voedingsmiddelen met een hoog natriumgehalte zijn onder andere spek, saladedressings, augurken, kaas, gezouten noten en instant soepen. Een tekort aan natrium leidt daarentegen tot spierkrampen en spasmen, cognitieve stoornissen, verwarring, vermoeidheid, maag- en darmklachten en andere problemen. Natrium is ook belangrijk voor planten en andere soorten. Het speelt een rol in de chlorofylsynthese en chlorofylstofwisseling.
Er zijn ook gezondheidsrisico’s. Als natrium reageert met water, worden er dampen gevormd die keel-, neus-, oog- en huidirritatie kunnen veroorzaken. Hoesten en niezen zijn andere bijwerkingen. Elementair natrium moet met zorg worden behandeld omdat het een hydroxide vormt dat bijtend is. Het reageert met oxides, zure oxiden en zuren. Tegelijkertijd heeft natriumhydroxide vele commerciële toepassingen en wordt het gebruikt in reinigingsmiddelen, de voedingsindustrie en chemische industrie. Interessant is dat het wordt gebruikt voor het chemisch pellen van groenten en fruit, bij de verwerking van cacao en de productie van chocolade, het verdikken van ijs, de productie van frisdranken en kleurstoffen en de verwerking van gevogelte. Als reinigingsmiddel wordt het gebruikt om eiwit- en vetafzettingen en olie- en vetvlekken te verwijderen. Ook in Chinese noedels en Duitse krakelingen bevatten kleine hoeveelheden.
In het verleden werd de verbinding gebruikt om vast te stellen of er sprake was van een koolmonoxidevergiftiging. Tegenwoordig worden andere methodes gebruikt waaronder bijvoorbeeld CO-oximeters. Alhoewel natrium belangrijk is voor de gezondheid en veel toepassingen kent, kan langdurige blootstelling leiden tot chronische bronchitis, voortplantingsproblemen, bijtende en thermische brandwonden, tintelingen en jeuk. Deze bijwerkingen treden op als gevolg van overmatig gebruik. In ernstige gevallen kan er blijvende schade optreden. In poedervorm is natrium in combinatie met andere stoffen giftig. Het is een gevaar voor het milieu wanneer het in het water terechtkomt.