Praseodymium
Inhoudsopgave
Wat is Praseodymium?
Praseodymium heeft atoomnummer 59 en symbool Pr. Het metaal werd in 1885 ontdekt door de Duitse chemicus Carl Auer von Welsbach. Het element werd in 1931 in redelijk zuivere vorm geïsoleerd. Tegenwoordig wordt het element gewonnen uit bastnasiet en monaziet zand. De belangrijkste vindplaatsen zijn de Verenigde Staten en China. De belangrijkste producenten van praseodymium zijn Brazilië, China en Rusland. De wereldvoorraad praseodymium wordt geschat op ongeveer 2 miljoen ton.
Gegevens
| Symbool | Pr |
| Volledige naam | Praseodymium |
| Atoomnummer | 59 |
| Atoommassa (g.mol-1) | 140,907 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,13 |
| Dichtheid (g.cm-3 bij 20 °) | 6,8 |
| Smeltpunt (°C) | 931 |
| Kookpunt (°) | 3512 |
| Vanderwaalstraal (nm) | — |
| Ionstraal (nm) | 0,101 (+3) |
| Isotopen | 1 |
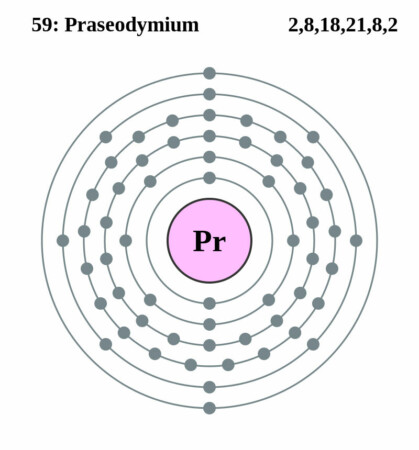
| Elektronenconfiguratie | [Xe]4f36s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 522 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1016 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2082,4 |
| Vierde ionisatiepotentiaal (kJ.mol-1 ) | 3752 |
| Vijfde ionisatiepotentiaal (kJ.mol-1 ) | 5534 |
| Standaard potentiaal (V) | -2,47 |
| Ontdekt door | von Welsbach in 1885 |
Praseodymium wordt geïsoleerd met behulp van solventextractie en ion exchange. Het wordt ook met behulp van calciumreductie uit samarium(III)chloride gewonnen. Praseodymium is een erg reactief element en het komt niet vrij voor in de natuur.
Praseodymium is gematigd giftig, het heeft een zilverachtige kleur en het is een taai en kneedbaar element. Praseodymium is paramagnetisch. Er zijn 38 radio-isotopen bekend en het kan verbindingen vormen met bromides, fluorides, oxides en anderen. Bekende isotopen zijn praseodymium-141, praseodymium-142 en praseodymium-144 dat een halfwaardetijd heeft van slechts 7,2 minuten.
Bij kamertemperatuur is praseodymium een vaste stof maar het reageert snel in water. Net zoals andere zeldzame aardmetalen moet praseodymium afgesloten in plastic of ondergedompeld in minerale olie worden bewaard. Praseodymium is ontvlambaar in de vorm van rook, stof en poeder. Het vormt met verdunde zuren en water, waterstofgas.
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 59 | Praseodymium | 141 Pr | 140,907648 | 100 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 121Pr | 120,95536 | 600 ms |
| 122Pr | 121,95181 | 500 ms |
| 123Pr | 122,94596 | 800 ms |
| 124Pr | 123,94296 | 1,2 s |
| 125Pr | 124,93783 | 3,3 s |
| 126Pr | 125,93531 | 3,12 s |
| 127Pr | 126,93083 | 4,2 s |
| 128Pr | 127,92879 | 2,84 s |
| 129Pr | 128,92510 | 32 s |
| 130Pr | 129,92359 | 40,0 s |
| 131Pr | 130,92026 | 1,50 min |
| 132Pr | 131,91926 | 1,49 min |
| 133Pr | 132,91633 | 6,5 min |
| 134Pr | 133,91571 | ± 11 min |
| 135Pr | 134,91311 | 24 min |
| 136Pr | 135,91269 | 13,1 min |
| 137Pr | 136,91070 | 1,28 uur |
| 138Pr | 137,91075 | 1,45 min |
| 139Pr | 138,90893 | 4,41 uur |
| 140Pr | 139,90907 | 3,39 min |
| 142Pr | 141,91004 | 19,12 uur |
| 143Pr | 142,91081 | 13,57 dagen |
| 144Pr | 143,91330 | 17,28 min |
| 145Pr | 144,91451 | 5,984 uur |
| 146Pr | 145,91764 | 24,15 min |
| 147Pr | 146,91899 | 13,4 min |
| 148Pr | 147,92213 | 2,29 min |
| 149Pr | 148,92372 | 2,26 min |
| 150Pr | 149,92667 | 6,19 s |
| 151Pr | 150,92831 | 18,90 s |
| 152Pr | 151,93150 | 3,63 s |
| 153Pr | 152,93384 | 4,28 s |
| 154Pr | 153,93752 | 2,3 s |
| 155Pr | 154,94012 | 1 s |
| 156Pr | 155,94427 | 500 ms |
| 157Pr | 156,94743 | 300 ms |
| 158Pr | 157,95198 | 200 ms |
| 159Pr | 158,95550 | 100 ms |
Toepassingen
Het kent verschillende industriële toepassingen. Zo wordt het gebruikt om metalen sterker te maken. Verbindingen van praseodymium worden gebruikt om glas en email te kleuren en infrarode straling te blokkeren. Praseodymium kan ook gebruikt worden als een oxidatiekatalysator. Soms worden kleine hoeveelheden toegevoegd aan vuursteentjes die in aanstekers zitten. Praseodymium komt ook voor in huishoudelijke apparatuur, spaarlampen en fluorescentielampen.
Gezondheid & Gevaren
Het element heeft geen biologische rol. De onoplosbare zouten van praseodymium zijn niet giftig en de oplosbare zouten zijn licht giftig bij inname. Ze kunnen irritatie aan ogen en huid veroorzaken. Langdurige blootstelling aan praseodymiumgassen kan wel leiden tot longembolie.
Vanuit de aardolie verwerkende industrie komt er praseodymium vrij en dit kan zich ophopen in waterbodems en grond. Het leidt tot een toenemend risico voor de voortplanting en het kan blijvende schade aan celmembranen veroorzaken. Daarnaast heeft het een negatieve werking op het zenuwstelsel.
Opname door de huid is onwaarschijnlijk maar inademing kan leiden tot irritatie van de bovenste luchtwegen. Inademing en blootstelling aan grote hoeveelheden kan leiden tot bronchitis, emfyseem en astma. Bij verandering van het gezichtsvermogen of irritatie moet onmiddellijk een arts geraadpleegd worden. Er is geen antistof beschikbaar. Resten praseodymium moeten in gesloten containers worden bewaard en afgevoerd.