Vanadium
Inhoudsopgave
Vanadium is een middelhard, staalblauw metaal. Hoewel het een minder bekend metaal is, is het behoorlijk waardevol in de maakindustrie vanwege zijn vervormbare, buigzame en corrosiebestendige eigenschappen.
Vanadium komt zelden als een vrij element in de natuur voor. Het is wel te vinden in ongeveer 65 verschillende mineralen waaronder magnetiet, vanadiniet, carnotiet en patroniet. Het is ook te vinden in fosfaatgesteente en sommige ruwe oliën. Vanadium wordt meestal verkregen door gemalen erts te verhitten in aanwezigheid van koolstof en chloor. Hiermee wordt vanadiumchloride geproduceerd en dan kan vervolgens in een argonatmosfeer en onder invloed van magnesium worden omgezet naar zuiver vanadium. Ongeveer 98% van het gewonnen vanadiumerts is afkomstig uit Zuid-Afrika, Rusland en China.
De kern van de Aarde bevat ongeveer 150 ppm vanadium en in de aardkost bedraagt het gehalte vanadium ongeveer 0,019%. De kosmische hoeveelheid vanadium in het heelal bedraagt ongeveer 0,0001%. Vanadium kan spectroscopisch worden gedetecteerd in de straling van de Zon en soms in het licht van andere sterren.
Chemische gegevens
| Symbool | V |
| Volledige naam | Vanadium |
| Atoomnummer | 23 |
| Atoommassa (g.mol-1 ) | 50,9415 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 1,63 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,11 |
| Smeltpunt (°C) | 1910 |
| Kookpunt (°C) | 3407 |
| Vanderwaalsstraal (nm) | 0,134 |
| Ionstraal | 0,074 (+3), 0,059 (+5) |
| Isotopen | 2 |
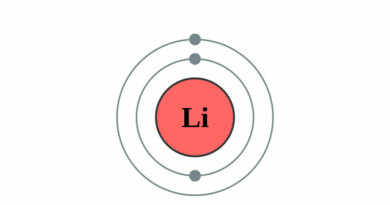
| Elektronenschil | [Ar]3d34s2 |
| Elektronen per schil | 2, 8, 11, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 650,9 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1414 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2830 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | ontdekt in 1801 door Andrés Manuel del Rio en in 1830 geïsoleerd door Nils Gabriel Sefstrom |
Ontdekking
Vanadium is twee keer ontdekt. In 1801 ontdekte Andrés Manuel del Rio, een professor in de mineralogie in Mexico het in een exemplaar van het mineraal vanadiet. Hij stuurde monsters van het element (dat hij erythronium had genoemd) samen met een brief waarin hij zijn methodes had beschreven naar het Institute de France voor inspectie en bevestiging. Tragisch genoeg ging zijn brief verloren in een schipbreuk en het Institute de France ontving alleen zijn monster samen met een kort briefje waarin werd verteld dat het nieuwe element op chroom leek. Het Institute de France concludeerde dat het monster in feite een chroommineraal was en del Rio trok zijn claim in.
Later, in 1830, werd het element herontdekt door de Zweedse chemicus Nils Gabriel Sefström. Hij analyseerde ijzer uit een mijn in Zweden. Mogelijk geïnspireerd door de prachtig gekleurde verbindingen van het element noemde Sefström het element vanadium, naar de oud-Noorse godin Vanadis. Vanadis is de oud-Noorse naam voor Freya en Freya wordt geassocieerd met schoonheid en vruchtbaarheid.
Het element werd uiteindelijk in 1867 geïsoleerd door de Engelse chemicus Sir Henry Enfield Roscoe. Hij combineerde vanadiumchloride (VCl3) met waterstofgas (H2).
Bohr-Rutherford diagram
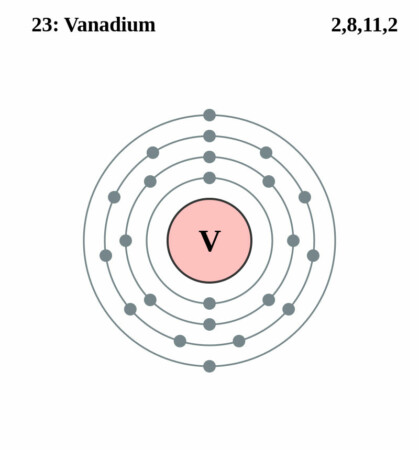
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|
| V | 50 V | 49,947156 | 0,25 |
| 51 V | 50,943957 | 99,7 |
Radioisotopen
| Nuclide | Atoommassa (u) | Halveringstijd |
|---|---|---|
| 40 V | 40,01109 | onbekend |
| 41 V | 40,99978 | onbekend |
| 42 V | 41,99123 | < 55 ns |
| 43 V | 42,98065 | 80 ms |
| 44 V | 43,97411 | 111 ms |
| 45 V | 44,965776 | 547 ms |
| 46 V | 45,9602005 | 422,50 ms |
| 47 V | 46,9549089 | 32,6 min |
| 48 V | 47,9522537 | 15,9735 dagen |
| 49 V | 48,9485161 | 329 dagen |
| 52 V | 51,9447755 | 3,743 min |
| 53 V | 52,944338 | 1,60 min |
| 54 V | 53,946440 | 49,8 s |
| 55 V | 54,94723 | 6,54 s |
| 56 V | 55,95053 | 216 ms |
| 57 V | 56,95256 | 0,35 s |
| 58 V | 57,95683 | 191 ms |
| 59 V | 58,96021 | 75 ms |
| 60 V | 59,96503 | 122 ms |
| 61 V | 60,96848 | 47,0 ms |
| 62 V | 61,97378 | 33,5 ms |
| 63 V | 62,97755 | 17 ms |
| 64 V | 63,98347 | 10 ms |
| 65 V | 64,98792 | 10 ms |
Sporenelement
Hoge doses vanadium zijn giftig voor mensen maar wetenschappers denken dat we het element in hele kleine hoeveelheid nodig hebben voor een normale botgroei. Vanadium komt als sporenelement in veel soorten voedsel voor. Het is aangetroffen in champignons, zwarte peper, peterselie, dille, schaaldieren, bier, wijn en graan. Als we een uitgebalanceerd dieet volgen dan consumeren we per dag slechts 0,01 milligram en dat is meer dan voldoende voor onze biologische behoeften.
Er zijn maar weinig vanadiumonderzoeken uitgevoerd waarbij mensen waren betrokken. De meeste experimenten werden uitgevoerd met dieren. Vanadium wordt momenteel niet aanbevolen voor bepaalde ziektes of gezondheidsproblemen. Verschillende dierstudies en een paar kleine studies bij mensen suggereren echter dat vanadium de bloedsuikerspiegel kan verlagen en de insulinegevoeligheid kan verbeteren bij patiënten met diabetes type 2.
In sommige onderzoeken met muizen werd bijvoorbeeld aangetoond dat vanadium de bloedsuikerspiegel verlaagt en de niveaus van LDL-cholesterol en triglyceriden verlaagt. In een studie met geiten werden jonge geiten van wie de moeders een dieet met een tekort aan vanadium consumeerden, geboren met skeletafwijkingen. Deze dieren stierven enkele dagen na de geboorte.
Bij veel van de menselijke studies met vanadium waren kleine aantallen mensen betrokken die gedurende korte tijd een hoge dosis kregen. Deze doses lagen ver boven de aanvaardbare bovengrens van inname en wetenschappers weten niet of deze niveaus zelfs veilig zijn voor menselijke consumptie.
In de vorm van vanadylsulfaat wordt vanadium verkocht als supplement voor bodybuilders. Het supplement word top de markt gebracht als een manier om de opname van glucose en aminozuren door spieren te verhogen en de synthese van glycogeen en eiwit te verbeteren. Volgens beperkt wetenschappelijk onderzoek lijkt vanadium de insulineactiviteit bij gezonde mensen echter niet te verbeteren, dit zou alleen bij diabetici werken.
Toepassingen
Ongeveer 80% van het geproduceerde vanadium wordt gelegeerd met ijzer om er een schokbestendig en corrosiebestendig staaladditief mee te maken. Dit staal wordt ferrovanadium genoemd. Ferrovanadium bevat 1 tot 6% vanadium.
Vanadiumstaallegeringen worden gebruikt om extreem taaie gereedschappen te maken zoals assen, pantserplaten, tandwielen, veren, snijgereedschap, zuigerstangen en krukassen. Vanadiumlegeringen worden ook gebruikt om kernreactoren te maken. Deze legeringen hebben lage neutronenabsorberende eigenschappen. Het eerste wijdverbreide industriële gebruik van vanadium was in het stalen frame van de Model T Ford. Het zorgde voor een lichter frame dat ook nog eens een grotere treksterkte had.
De verbinding vanadiumpentoxide (V2O5) wordt gebruikt als beitsmiddel (een stof die kleurstoffen permanent aan weefsels laat hechten), als katalysator bij sommige chemische reacties en bij de productie van keramiek. Het kan worden gecombineerd met gallium om er supergeleidende magneten mee te maken. Vanadium kan, gemengd met aluminium en titanium, een zeer sterke legering vormen die wordt gebruikt voor speciale toepassingen zoals tandheelkundige implantaten en straalmotoren.
Weetjes
- Het inhalen van grote hoeveelheden vanadium kan leiden tot longproblemen zoals bronchitis of longontsteking. Het is aangetoond dat werknemers die aan vanadiumperoxide worden blootgesteld gevoeliger zijn voor irritatie van ogen, neus en keel.
- Tijdens de Eerste Wereldoorlog werd vanadium gebruikt bij de productie van draagbare artilleriestukken en kogelvrije vesten.
- Vanadium heeft zeer kleurrijke oxidatietoestanden waaronder paars, groen, geel en blauw.
- In 1911 ontdekte de Duitse chemicus Martin Henze vanadium in de bloedcellen van in zee levende zakpijpen.
- Vanadium atomen hebben 23 elektronen, 28 neutronen en 23 protonen.
- Omdat vanadiumstraal zijn hardheid behoudt bij hoge temperaturen wordt het gebruikt in cirkelzagen, boren, motorturbines en andere bewegende delen die veel warmte produceren.
- Vanadium kan worden gebruikt bij het raffineren van uranium voor nucleaire doeleinden.
- Vanadium is aanwezig in een klein aantal meteorieten.