Europium
Inhoudsopgave
Wat is Europium?
Europium, vernoemd naar het continent Europa, heeft atoomnummer 63 en symbool Eu. Het oxideert gemakkelijk in water en lucht. Europium behoort tot de lanthaniden, ook wel de zeldzame aardmetalen genoemd. Het is een zwaar metaal maar desondanks relatief onschadelijk.
Gegevens
| Symbool | Eu |
| Volledige naam | Europium |
| Atoomnummer | 63 |
| Atoommassa (g.mol-1 ) | 151,25 |
| Elektronegativiteit (Pauling) | 1,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 5,2 |
| Smeltpunt (°C) | 822 |
| Kookpunt (°C) | 1597 |
| Vanderwaalstraal (nm) | |
| Ionstraal (nm) | |
| Isotopen | 2 natuurlijke isotopen |
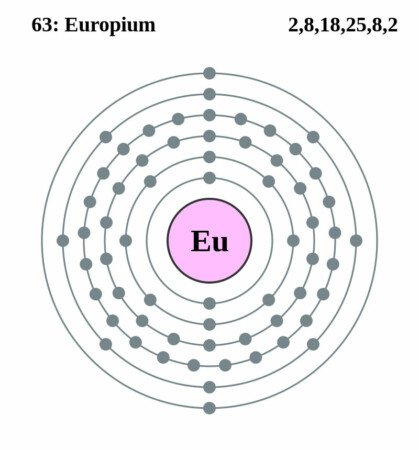
| Elektronenconfiguratie | [Xe]4f76s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 547,11 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1084,6 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2404,43 |
| Ontdekt door | Lecoq de Boisbaudran in 1890 |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 63 | Europium | 151 Eu | 150,919846 | 47,81 |
| 153 Eu | 152,921226 | 52,19 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 130Eu | 129,96357 | 1,1 ms |
| 131Eu | 130,95775 | 17,8 ms |
| 132Eu | 131,95437 | 100 ms |
| 133Eu | 132,94924 | 200 ms |
| 134Eu | 133,94651 | 0,5 s |
| 135Eu | 134,94182 | 1,5 s |
| 136Eu | 135,93960 | 3,3 s |
| 137Eu | 136,93557 | 8,4 s |
| 138Eu | 137,93371 | 12,1 s |
| 139Eu | 138,92979 | 17,9 s |
| 140Eu | 139,92809 | 1,51 s |
| 141Eu | 140,92493 | 40,7 s |
| 142Eu | 141,92343 | 2,36 s |
| 143Eu | 142,92029 | 2,59 min |
| 144Eu | 143,91881 | 10,2 s |
| 145Eu | 144,91626 | 5,93 dagen |
| 146Eu | 145,91720 | 4,61 dagen |
| 147Eu | 146,91674 | 24,1 dagen |
| 148Eu | 147,91808 | 54,5 dagen |
| 149Eu | 148,91793 | 93,1 dagen |
| 150Eu | 149,91970 | 36,9 jaar |
| 151Eu | 150,91985 | 5 * 1018 jaar |
| 152Eu | 151,92174 | 13,537 jaar |
| 154Eu | 153,92297 | 8,593 jaar |
| 155Eu | 154,92289 | 4,7611 jaar |
| 156Eu | 155,92475 | 15,19 d |
| 157Eu | 156,92542 | 15,18 uur |
| 158Eu | 157,92785 | 45,9 min |
| 159Eu | 158,92908 | 18,1 min |
| 160Eu | 159,93197 | 38 s |
| 161Eu | 160,93368 | 26 s |
| 162Eu | 161,93704 | 10,6 s |
| 163Eu | 162,93921 | 6 s |
| 164Eu | 163,94299 | 2 s |
| 165Eu | 164,94572 | 1 s |
| 166Eu | 165,94997 | 400 ms |
| 167Eu | 166,95321 | 200 ms |
Ontdekking
Europium werd in 1896 ontdekt door de Franse chemicus Eugene-Antole Demarcay. Hij merkte op dat monsters samarium, dat kort daarvoor was ontdekt, verontreinigd waren met een onbekende stof. Demarcay kon echter geen zuiver europium produceren. Tegenwoordig wordt europium voornamelijk gewonnen uit monasietzanden. Europium heeft een belangrijke biologische rol.
Europia of europiumoxide wordt veelal gebruikt als een doteermiddel in computermonitoren en televisies. Blauwe straling wordt geproduceerd m.b.v. europium 2+ en rode straling met behulp van europium 3+. De combinatie van beiden levert wit licht op en dat wordt gebruikt in fluorescerende lampen.
Fosforverbindingen met europium worden gebruikt als anti-fraudemarkeringen op Euro-biljetten. Ook in de geochemie en de petrochemie wordt europium gebruikt om het proces over het ontstaan van gesteente, ontstaan uit magma of lava te bestuderen.
Europium is een buigzaam metaal en dat betekent dat het kneedbaar en gemakkelijk te vormen is. Van alle zeldzame aardmetalen heeft europium de kleinste dichtheid en het op een na laagste smeltpunt. Onder 1,8 Kelvin is europium een supergeleider. Om dit te bereiken moet het element wel tot meer dan 80 GPa worden samengeperst. Het element is ook het meest reactief van alle zeldzame aardmetalen. Het oxideert snel in de lucht en het reageert ook met water. Europium vormt dan europium(iii)oxide en is oplosbaar in verdund zwavelzuur waar het gehydrateerd Eu (III) vormt.
Europium heeft twee isotopen: 151Eu en 153Eu. De laatste is de meest voorkomende en het is ook het stabielste isotoop. Isotopen van Europium zijn goede neutronenvangers en ze worden daarom gebruikt on controlestaven in kernreactoren.
Europium heeft ook 35 kunstmatige isotopen. Van deze kunstmatige isotopen in Eu-150 met een halfwaardetijd van 36,9 dagen het meest stabiel.
Bij kernsplitsing komt er europium vrij als bijproduct. Het is minder radioactief dan cesium en strontium. Veel in de natuur voorkomende mineralen bevatten Europium. Het wordt het meeste gevonden in bastnasiet, monaziet, xenotiem en lopariet. Europium komt in zuivere vorm niet in de natuur voor.
Europiummetaal reageert met alle halogenen. Dit levert grijs europium(III)bromide (EuBr3), geel europium(III)chloride, wit europium(III)fluoride en kleurloos europium(III)jodide op. Europium(II)oxide en het gemengde oxide zijn de meest voorkomende oxides.