Magnesium
Inhoudsopgave
Wat is magnesium?
Magnesium is een bekend chemisch element met atoomnummer 12 in het periodiek systeem. Het element heeft het symbool Mg en het is een van de elementen die veel voorkomen in de korst van de Aarde en in het hele heelal. Ongeveer 13% (m/m) van de aardse korst bestaat uit magnesium. De grote hoeveelheid is te verklaren doordat het gemakkelijk ontstaat bij sterren die als een supernova exploderen. Magnesium is goed oplosbaar in water, het is een van de veelvoorkomende metalen die goed oplosbaar zijn in water.
Chemische gegevens
| Symbool | Mg |
| Volledige naam | Magnesium |
| Atoomnummer | 12 |
| Atoommassa (u) | 24,312 |
| Groep | aardalkali metalen |
| Elektronegativiteit (Pauling) | 1,2 |
| Dichtheid (g.cm-3 bij 20°C) | 1,74 |
| Smeltpunt (°C) | 650 |
| Kookpunt (°C) | 1107 |
| Vanderwaalstraal (nm) | 0,16 |
| Ionstraal (nm) | 0,065 |
| Isotopen | 3 |
| Elektronenconfiguratie | [Ne]3s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 737,5 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1450 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 7733 |
| Standaard potentiaal (V) | -2,34 |
| Ontdekt door | Joseph Black in 1755 |
Bohr-Rutherford diagram
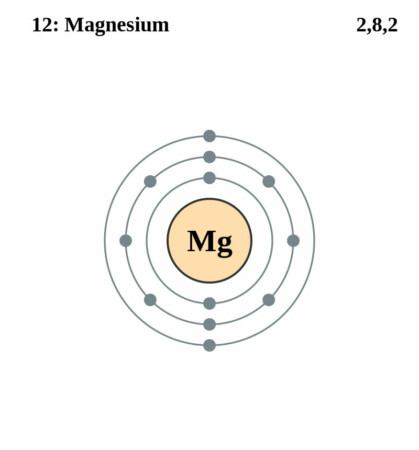
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 12 | Magnesium | 24 Mg | 23,985042 | 78,99 |
| 25 Mg | 24,985837 | 10,00 | ||
| 26 Mg | 25,982593 | 11,01 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 19 Mg | 19,03547 | onbekend |
| 20 Mg | 20,018863 | 90,8 ms |
| 21 Mg | 21,011713 | 122 ms |
| 22 Mg | 21,9995738 | 3,8755 s |
| 23 Mg | 22,9941237 | 11,317 s |
| 24 Mg | 23,985041700 | stabiel |
| 25 Mg | 24,98583692 | stabiel |
| 26 Mg | 25,982592929 | stabiel |
| 27 Mg | 26,98434059 | 9,458 min |
| 28 Mg | 27,9838768 | 20,915 uur |
| 29 Mg | 28,988600 | 1,30 s |
| 30 Mg | 29,990434 | 335 ms |
| 31 Mg | 30,996546) | 230 ms |
| 32 Mg | 31,998975 | 86 ms |
| 33 Mg | 33,005254 | 90,5 ms |
| 34 Mg | 34,00946 | 20 ms |
| 35 Mg | 35,01734 | 70 ms |
| 36 Mg | 36,02300 | 3,9 ms |
| 37 Mg | 37,03140 | 40 ms |
| 38 Mg | 38,03757 | 1 ms |
| 39 Mg | 39,04677 | < 260 ns |
| 40 Mg | 40,05393 | 1 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Voorkomen
Magnesium wordt in grote hoeveelheden in verschillende mineralen, zoals serpentijn, olivijn, magnetiet, dolomiet en anderen, gevonden. Het is het op twee na meest voorkomende element, na ijzer en aluminium, in de korst van de Aarde. Het wordt ook gevonden in zoutlagen, zeewater en ondergronds pekelwater.
Ongeveer 45% van de wereldbehoefte aan magnesium wordt geproduceerd in de Verenigde Staten. Magnesiet en dolomiet worden middels mijnbouw gedolven in landen als Griekenland, Rusland, Oostenrijk, Slowakije, Noord Korea, Turkije en China. Magnesium wordt voornamelijk door middel van elektrolyse gewonnen uit magnesiumzouten van pekel.
Magnesium komt in de natuur niet als vrij element voor want het is nogal reactief. Als vrij metaal brandt het met een fel wit licht. De reactiviteit wordt gedeeltelijk geremd doordat het na de reactie met een laagje oxide wordt bedekt.
Verbindingen met magnesium komen meestal voor als witte kristallen. Een groot deel hiervan is oplosbaar in water. Magnesium heeft 3 stabiele isotopen: 24Mg, 25Mg en 26Mg. Het overgrote deel van magnesium komt voor het isotoop met massa 24. Magnesium is een licht metaal en het heeft een zilverwitte kleur. Het reageert heftig met water. Magnesium reageert ook met zoutzuur en met andere zuren. Er komt dan een grote hoeveelheid waterstof vrij.
Magnesium is extreem licht ontvlambaar maar niet in grote hoeveelheden. Als het begint te branden is het vuur lastig te doven. Dat komt omdat magnesium ook in stikstof, water en kooldioxide kan branden. Hierbij worden dan verschillende verbindingen gevormd. De enige manier om een magnesiumbrand te doven is afdekken met zand zodat alle contact met de atmosfeer wordt verbroken.
Toepassingen
In de beginjaren van de fotografie werd magnesium gebruikt als lichtbron. Het geeft namelijk een helder licht als het in lucht brandt. Tegenwoordig wordt magnesium nog gebruikt voor vuurwerk en flares. Als het brandt kan het een temperatuur tot wel 3100 °C bereiken. Magnesium wordt veel toegepast in aluminiummagnesiumlegeringen. Magnesium wordt ook veel in kunstmest toegepast maar ook in laxeermiddelen, medicijnen voor zenuwen en de behandeling van krampen van bloedvaten.
Gevaren & Gezondheid
Het element heeft een zure smaak en daardoor is het bruikbaar om in kleine hoeveelheden de smaak van mineraalwater aan te passen. Magnesium komt ook veel voor in os lichaam. Magnesium speelt een belangrijke rol in het maken van DNA. Mensen hebben minimaal 200 mg magnesium per dag nodig en een mens kan tot 350 mg magnesium per dag opnemen. Het menselijk lichaam gaat heel efficiënt om met magnesium. Grote hoeveelheden worden gerecycled en het lichaam neemt magnesium op uit het voedsel. Langdurige inname van grote hoeveelheden magnesium zal echter leiden tot verwarring, lusteloosheid en spierslapte.