Lithium
Inhoudsopgave
Beschrijving
Lithium is een lid van de alkalimetalen groep van elementen. Het is zacht, zilverwit van kleur. Lithium heeft atoomnummer 3 en draagt het symbool Li. De andere alkalimetalen zijn natrium, cesium, rubidium, kalium en francium. Als je naar beneden gaat in het periodiek systeem dan nemen kookpunten en smeltpunten van de alkalimetalen toe. Ook neemt hun elektronegativiteit af terwijl hun reactiviteit toeneemt.
Gegevens lithium
| Symbool | Li |
| Volledige naam | Lithium |
| Atoomnummer | 3 |
| Atoommassa (g.mol-1 ) | 6,94 |
| Groep | Alkalimetalen |
| Elektronegativiteit (Pauling) | 1,0 |
| Dichtheid (g.cm-3 bij 20 °C) | 0,53 |
| Smeltpunt (°C) | 180,5 |
| Kookpunt (°C) | 1342 |
| Vanderwaalsstraal (nm) | 0,145 |
| Ionstraal (nm) | 0,06 |
| Isotopen | 2 |
| Elektronenschil | 1s2 2s1 of (He)2s1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 520,1 |
| Standaard potentiaal (V) | -3,02 |
| Ontdekt door | Johan Arfwedson in 1817 |
Van alle vaste elementen heeft lithium de kleinste dichtheid en is het het minst zware element. Lithium is licht ontvlambaar en reactief en daarom wordt het meestal bewaard in een minerale olie (paraffine olie bijvoorbeeld). Lithium reageert heftig aan de lucht en als het in contact komt met water verandert het oppervlak snel naar dof grijs en daarna zwart. Het element komt nooit vrij voor in de natuur, we vinden het alleen als deel van een verbinding. Lithium wordt vaak gewonnen uit klei of pekelwater. Het wordt ook synthetisch geïsoleerd op kalium- en lithiumchloride.
Lithium is een relatief instabiel element en dat komt omdat de stabiele isotopen een lage bindingsenergie hebben. Dit betekent dat ze niet geneigd zijn te splitsen. Dit is er ook de oorzaak van dat lithium minder in het heelal voorkomt dan verschillende andere elementen die een groter atoomgewicht hebben. Lithium werd in 1932 gebruikt tijdens een nucleair experiment dat dateert van voor de tijd van de atoombom. De atomen lithium werden omgezet naar helium.
Van alle niet-gasvormige elementen heeft lithium de kleinste dichtheid. Het volgende element, kalium, heeft een bijna tweemaal zo grote dichtheid. In vaste of vloeibare vorm zijn lithium, waterstof en helium de elementen met de kleinste dichtheid.
Bohr-Rutherford diagram
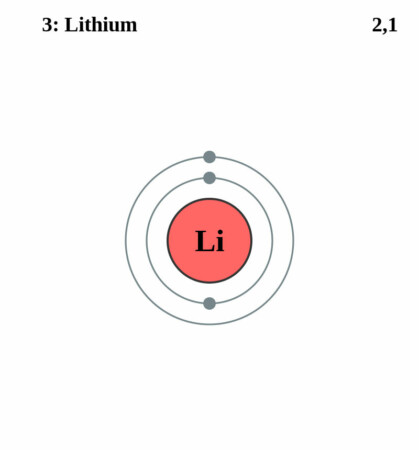
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa | Abundantie (%) |
|---|---|---|---|
| Lithium | 6 Li | 6,015122 | 7,59 |
| 7 Li | 7,016004 | 92,41 |
Radioactieve isotopen
| Symbool | Atoommassa | Halfwaardetijd |
|---|---|---|
| 3 Li | 3,030775 | onbekend |
| 4 Li | 4,027186 | 91 * 10-24 s |
| 5 Li | 5,012538 | 370 – 10-24 s |
| 8 Li | 8,022487 | 839,4 ms |
| 9 Li | 9,026789 | 178,3 ms |
| 10 Li | 10,035484 | 2 * 10-21 s |
| 11 Li | 11,043798 | 8,75 ms |
| 12 Li | 12,05378 | < 10 ns |
| 13 Li | 13,06117 | 3,3 * 10-21 s |
Spectra
Absorptiespectrum
Emissiespectrum
Toepassingen
Lithium en lithium houdende componenten worden gebruikt voor het maken van legeringen voor vliegtuigen, voor batterijen, hittebestendige keramische materialen, glas en andere commerciële toepassingen. Lithium wordt ook gebruikt in vetten. Lithiumhydroxide is een sterke base die je kan gebruiken om met een vet te verzepen. Lithiumstearaat kan gebruikt worden om oliën te verdikken. Deze lithiumzeep wordt gebruikt voor de productie van vetten die bestand zijn tegen hoge temperaturen. Lithiumbromide en lithiumchloride worden gebruikt als droogmiddelen. Dit zijn hygroscopische stoffen die vocht opnemen. Metallisch lithium Li[AlH4], en andere complexe hydrides worden als hoge energie additieven toegevoegd aan raketbrandstof. Daarnaast worden lithiumnitraat, lithiumperchloraat, lithiumchloraat en lithiumperoxide gebruikt in zuurstofkaarsen en als oxidatoren in raketbrandstoffen.
Het veel gebruikte lithiumhydroxide wordt gemaakt uitgaande van lithiumcarbonaat.
Gezondheid & Gevaar
In alle organismes komen hele kleine hoeveelheden lithium voor maar lithium is niet essentieel voor hun bestaan. Lithium wordt gebruikt om de symptomen van bipolaire stoornissen en andere psychiatrische aandoeningen te behandelen. Het is aanwezig als bestanddeel in een aantal stemmingsstabilisatoren. Lithium was de eerste stemmingsstabilisator die door de Amerikaanse Food and Drug Association (FDA) werd goed gekeurd. De maximale dosis bedraagt 1,2 mmol/L. Een overdosis lithium kan namelijk erg pijnlijk zijn. Een overdosis lithium kan zich uiten in misselijkheid, braken, verlies van spiercontrole en diarree. Andere, minder vaak voorkomende bijwerkingen zijn trillingen en wazig zicht. Het verlagen van de dosis doet deze bijwerkingen verdwijnen.