Helium
Inhoudsopgave
Beschrijving
Helium heeft atoomnummer 2 en symbool He. Het is een niet giftig, smaakloos, geurloos en kleurloos gas. Het behoort tot de edelgassen. Helium is een monoatomisch gas waarvan, vergeleken met andere elementen, smeltpunt en kookpunt tot de allerlaagste behoren. Met uitzondering van extreme omstandigheden komt helium alleen als gas voor.
Helium is ook het op een na lichtste element en het op een na meest voorkomende element. Het maakt ongeveer 24% uit van de totale elementaire massa van het heelal. In het heelal komt ongeveer 24 * meer helium voor dan alle zwaardere elementen bij elkaar. Vanwege de hoge bindingsenergie is het percentage helium in Jupiter ongeveer gelijk aan dat van de Zon. Helium-4 komt het meest voor en ook dit komt door de bindingsenergie. Helium-4 ontstaat uit kernfusiereacties en als gevolg van radioactief verval. Het meeste helium dat we in het heelal aantreffen is helium-4. De kernfusie van waterstof die plaatsvindt in het binnenste van sterren is verantwoordelijk voor de hedendaagse heliumproductie.
Op Aarde wordt het meeste helium geproduceerd als gevolg van radioactief verval. Er is een beetje helium aanwezig in de atmosfeer maar isolatie en scheiding van de lucht is ontzettend duur. Helium scheiden van enkele natuurlijke gassen is veel goedkoper en efficiënter. In de Verenigde Staten zijn gassen gevonden waar tot 7% helium in zit. Om helium van deze gassen te scheiden worden de gassen vloeibaar gemaakt en worden er verschillende scheidingstechnieken toegepast. Dit wordt meestal niet gedaan onder laboratoriumomstandigheden. Helium wordt onder druk bewaard in cilinders.
Chemische gegevens
| Symbool | He |
| Volledige naam | Helium |
| Atoomnummer | 2 |
| Atoommassa (g.mol-1 ) | 4,002602 |
| Groep | Edelgassen |
| Elektronegativiteit (Pauling) | — |
| Dichtheid (g.cm-3 bij 20 °C) | 0,178 * 10-3 |
| Smeltpunt (°C) | -272,6 |
| Kookpunt (°C) | -268,9 |
| Vanderwaalsstraal (nm) | 0,118 |
| Ionstraal | —- |
| Isotopen | 2 |
| Elektronenschil | 1s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 2372 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 5251 |
| Ontdekt door: | Ramsey in 1895 |
Bohr – Rutherford diagram
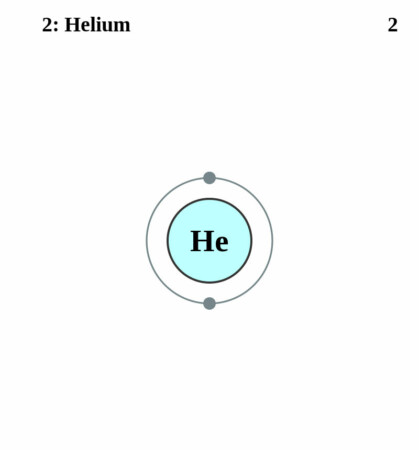
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa | Abundantie (%) |
|---|---|---|---|
| Helium | 3 He | 3,016029 | 0,000137 |
| 4 He | 4,002603 | 99,999863 |
Radioactieve isotopen
| Symbool | Atoommassa | Halfwaardetijd |
|---|---|---|
| 5 He | 5,012224 | 700 * 10-24 s |
| 6 He | 6,018889 | 806,92 ms |
| 7 He | 7,028021 | 2,51 * 10-21 s |
| 8 He | 8,033922 | 119,1 ms |
| 9 He | 9,043950 | 2,5 * 10-21 s |
| 10 He | 10,052399 | 3,1 * 10-21 s |
Spectra
Absorptiespectrum
Emissiespectrum
Toepassingen
Helium heeft verschillende toepassingen. Zo worden mengsels van helium en zuurstof als kunstmatige lucht gebruikt. Het wordt gebruikt om ballonnen te vullen en om vloeibare brandstofraketten onder druk te zetten. Helium is zwaarder dan waterstof en veiliger te gebruiken in ballonnen omdat het niet kan branden.
In de halfgeleiderindustrie wordt het gebruikt om een inerte omgeving te creëren die geschikt is om germaniumkristallen en siliciumkristallen te laten groeien. Helium wordt ook gebruikt bij de productie van zirkonium en titanium. In de gaschromatografie wordt helium gebruikt als draaggas. Vanwege zijn lage temperatuur kan helium gebruikt worden als supergeleider.
Vanwege de calorische en thermische aard, de warmtecapaciteitsverhouding, hoge geluidssnelheid en inertheid wordt helium ook gebruikt in supersonische windtunnels. Bij het booglassen wordt het element gebruikt als beschermend gas voor materialen die bij de lastemperatuur verzwakken en vervuilen door stikstof of lucht. Sommige beschermde gassen die inert zijn worden gebruikt bij het wolfraam booglassen. Voor materialen met een hoge warmtegeleiding zoals koper en aluminium, wordt helium gebruikt in plaats van argon.
Helium wordt ook gebruikt in de lekdetectie. Heliumdiffusie door vaste stoffen gaat tot driemaal sneller dan de diffusie van lucht. Het wordt dus gebruikt om lekken te detecteren in hoge-temperatuur containers, cryogene tanks en andere apparatuur die onder en hoog vacuüm werkt. Om een object te testen wordt het in een ruimte geplaatst en vervolgens gevuld met helium nadat het is gevacumeerd.
Helium wordt ook gebruikt in de rakettechniek. Het dient als een ullage medium waar oxidatoren en brandstof worden verplaatst om zuurstof en waterstof te condenseren en raketbrandstof te produceren. Voorafgaand aan de lancering wordt helium gebruikt om oxidatoren en brandstof uit de apparatuur te verdrijven.