Kalium
Inhoudsopgave
Puur kalium is een sterk reactief metaal. Blootgesteld aan water explodeert het met een paarse vlam. Voor de veiligheid wordt het in olie bewaard.
Omdat het zo reactief is komt het niet vrij in de natuur voor. Maar mineralen en verbindingen die kalium bevatten zijn wel algemeen. Het is qua hoeveelheid het zevende element in de korst van de Aarde.
Natuurlijk voorkomende kaliumzouten zoals salpeter en potas worden al eeuwenlang gebruikt maar niemand isoleerde kalium tot 1870 toen de scheikundige Humphry Davy uit Cornwall in Engeland het idee had om een elektrische stroom door een natte potas (kaliumcarbonaat) te laten lopen. De stroom verbrak de bindingen die de componenten bij elkaar hielden. Davy zou later de truc herhalen om natrium te ontdekken.
Het was ook Davy die als eerste de explosieve paarse reactie van kalium op water opmerkte. De verbranding vindt plaats omdat de combinatie van kalium en water kaliumhydroxide maakt (KOH) en waterstofgas (H2) en hitte. Door de hitte ontsteekt het waterstofgas. Deze reactie is explosief.
Chemsiche gegevens
| Symbool | K |
| Volledige naam | Kalium |
| Atoomnummer | 19 |
| Atoommassa (g.mol-1 ) | 39,0983 |
| Groep | alkalimetalen |
| Elektronegativiteit (Pauling) | 0,8 |
| Dichtheid (g.cm-3 bij 20 °C) | 0,862 |
| Smeltpunt (°C) | 63,5 |
| Kookpunt (°C) | 759 |
| Vanderwaalsstraal (nm) | 0,275 |
| Ionstraal (nm) | 0,133 (+1) |
| Isotopen | 5 waarvan 2 stabiel |
| Elektronenschil | [Ar]4s1 |
| Elektronen per schil | 2, 8, 8, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 418,8 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 3052 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 4420 |
| Standaard potentiaal (V) | |
| Ontdekt door | 1807 door Humphry Davy |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 19 | Kalium | 39 K | 38,963707 | 93,2584 |
| 40 K | 39,963999 | 0,0117 | ||
| 41 K | 40,961826 | 6,7302 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 33K | 33,00726 | < 25 ns |
| 34K | 33,99841 | < 40 ns |
| 35K | 34,988010 | 178 ms |
| 36K | 35,981292 | 342 ms |
| 37K | 36,97337589 | 1,226 s |
| 38K | 37,9690812 | 7,636 min |
| 40K | 39,96399848 | 1,248 × 109 jaar |
| 42K | 41,96240281 | 12,360 uur |
| 43K | 42,960716 | 22,3 uur |
| 44K | 43,96156 | 22,13 min |
| 45K | 44,960699 | 17,3 min |
| 46K | 45,961977 | 105 s |
| 47K | 46,961678 | 17,50 s |
| 48K | 47,965514 | 6,8 s |
| 49K | 48,96745 | 1,26 s |
| 50K | 49,97278 | 472 ms |
| 51K | 50,97638 | 365 ms |
| 52K | 51,98261 | 105 ms |
| 53K | 52,98712 | 30 ms |
| 54K | 53,99420 | 10 ms |
| 55K | 54,99971 | 3 ms |
Algemeen voorkomend en soms dodelijk
Ongeveer 2,4% van de massa van de aardkorst bestaat uit kalium, waaronder ook miljarden tonnen kaliumchloride. Het is niet verwonderlijk dat mensen gebruik hebben gemaakt van deze hulpbron. Salpeter (kaliumnitraat) werd in de middeleeuwen gebruikt om voedsel te bewaren en het maakt deel uit van buskruit dat in het China van de 9de eeuw werd uitgevonden. Kaliumaluin (KAl(SO4)2) kan voorkomen in deodorant (het remt de groei van bacteriën) of in de productie van textiel en leer. Potas, een verzamelnaam voor elk zout dat in water oplosbaar kalium bevat, is een belangrijk ingrediënt in meststoffen.
Het woord “potas” komt van “pot as” en verwijst terug naar de oorspronkelijke productiemethode van deze zouten. Planten zijn rijk aan kalium dus mensen verzamelden houtas en ze loogden de kaliumzouten eruit voor gebruik in kunstmest. Tegenwoordig wordt potas gedolven. Jaarlijks wordt er ongeveer 35 miljoen ton uit de bodem gehaald.
Kalium is ook een noodzakelijke voedingsstof voor leven; als elektrolyt geleidt het elektrische signalen in het lichaam; samen met natrium is het cruciaal voor een goede spiercontractie. Kaliumchloride wordt vaak als medicijn gebruikt om kaliumtekorten te behandelen maar de dosis maakt het ook een gif. Kaliumchloride is gebruikt bij dodelijke injecties. In voldoende grote hoeveelheden stopt kaliumchloride het hart door de elektrische signalen te verstoren die de hartspier dwingen om samen te trekken en te ontspannen.
Bohr – Rutherford diagram
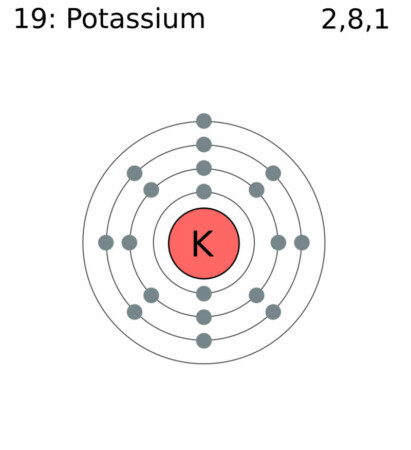
By Greg Robson – Application: Inkscape, CC BY-SA 2.0 uk,
Weetjes
Een laag kaliumgehalte in het lichaam wordt hypokaliëmie genoemd. Symptomen zijn onder meer spierkrampen, zwakte en een onregelmatige hartslag. Een hoog kaliumgehalte wordt hyperkaliëmie genoemd en het veroorzaakt vergelijkbare symptomen.
Je kaliumspiegel kan echter afwijken zonder deze extreme symptomen. Bepaalde bloedrukmedicijnen kunnen leiden tot lage kaliumspiegels en dit verhoogt op zijn beurt het risico op diabetes type 2.