Kobalt
Inhoudsopgave
Schitterend blauw kobalt is een transitiemetaal dat zich midden in het periodiek systeem bevindt. In onzuivere vorm is het lange tijd als pigment gebruikt. Tegenwoordig treffen we kobalt aan in magneten, turbines en zelfs in behandelingen tegen kanker.
In zuivere vorm is kobalt een zilverblauw, bros metaal. Het kan magnetisch gemaakt worden en is daarmee vergelijkbaar met ijzer en nikkel. In sterke magneten worden legeringen van kobalt en aluminium of nikkel gebruikt. Het radioactieve isotoop 60Co wordt gebruikt voor de behandeling van kanker. Er komt gammastraling vrij die gericht kan worden op tumoren. Dit is in het bijzonder het geval bij de behandeling van hersentumoren.
De feitjes
| Symbool | Co |
| Volledige naam | Kobalt |
| Atoomnummer | 27 |
| Atoommassa (g.mol-1 ) | 58,933 |
| Groep | transitiemetaal |
| Elektronegativiteit (Pauling) | 1,88 |
| Dichtheid (g.cm-3 bij 20 °C) | 8,90 |
| Smeltpunt (°C) | 1495 |
| Kookpunt (°C) | 2927 |
| Vanderwaalsstraal (nm) | 0,125 |
| Ionstraal (nm) | 0,078 )+2), 0,063 (+3) |
| Isotopen | 1 stabiel, 7 radioactief |
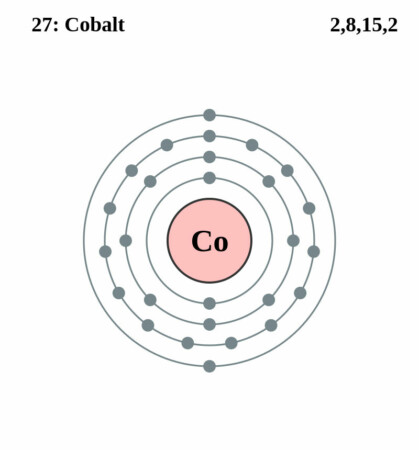
| Elektronenschil | [Ar]3d74s2 |
| Elektronen per schil | 2, 8, 15, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 760,4 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1648 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3232 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1735, door Georg Brandt |
Bohr-Rutherford diagram
De Kobaltcontroverse
Kobaltzouten werden gebruikt om oud Chinees aardewerk te versieren met schitterende blauwe ontwerpen. Andere beschavingen ontdekten het artistieke potentieel van kobalt zonder te weten welk metaal ze gebruikten. Een studie uit 2014 vond kobaltblauwe graskralen in een Deens graf van 3400 jaar oud. Hetzelfde glas werd gevonden in oude Egyptische graven, waaronder dat van koning Toetanchamon. De ontdekking verwijst naar handelsverbindingen die de twee afgelegen locaties met elkaar verbinden.
Afgezien van de oorsprong werd kobalt zelf pas omstreeks 1730 ontdekt en zelfs toen duurde het jaren voordat de wetenschappelijke gemeenschap het erover eens was dat dit nieuwe metaal bestond. Tot in de 18de eeuw werden pigmenten van kobalt “smalt” of saffloer” genoemd en men dacht dat ze gemaakt waren van bismut, koper, ijzer en arseen. Toen haalde de Zweedse wetenschapper George Brandt een onbekend metaal uit een erts uit de Riddarhyttan mijnen in Zweden (deze mijnen waren eigendom van de familie Brandt).
Brandt beschreef het metaal en zijn eigenschappen inclusief zijn magnetisme. Hij beschreef zelfs wat er gebeurt als kobalt in ammoniak wordt opgelost (het wordt rood als kersensap). De ontdekking was controversieel en zelfs in 1760 moest Brandt zijn vondst nog steeds verdedigen tijdens een lezing voor de Academie van Wetenschappen in Zweden. In 1780 werden zijn bevindingen bevestigd door zijn collega Torbern Bergman.
Isotopen
Het enige stabiele isotoop is 59 Co. In de natuur kan ook radioactief kobalt voorkomen. In augustus 2014 rapporteerde een team van astrofysici de ontdekking van 56 Co in de supernova SN2014J. Deze supernova vond plaats op een afstand van 11 miljoen lichtjaar van de Aarde. De supernova stootte ongeveer 60% van de massa van de Zon uit in 56 Co. Het isotoop heeft een halfwaardetijd van 77 dagen en vervalt geleidelijk tot 56 Fe.
Weetjes
- De naam kobalt is afkomstig van het Duitse woord voor kabouter: Kobold. Middeleeuwse mijnwerkers vonden dit element lastig omdat het erts bij smelten giftige dampen afgeeft.
- Kobalt is een essentieel sporenelement voor de gezondheid. Het vormt de ruggengraat voor vitamine B12, en die vitamine is de sleutel tot bloedvorming en de werking van het zenuwstelsel.
- In 2010 maakten Duitse wetenschappers de eerste beelden van de verandering van de “spin” van een atoom. (Spin is een eigenschap die het impulsmoment beschrijft van elektronen die rond een kern draaien). Ze gebruikten hiervoor kobalt.
- Net als in de oudheid wordt kobalt tegenwoordig nog steeds gebruikt in pigmenten. Jaarlijks gaat ongeveer 30% van de geproduceerde kobalt naar de keramiek- en verfindustrie.
- Kobalt behoudt zijn magnetisme tot een temperatuur van ± 1121 °C.
Huidig onderzoek
Hoewel kobalt nog steeds in pigmenten wordt gebruikt speelt het verschillende rollen in de moderne technologie. In september 2014 meldden onderzoekers in Denemarken dat ze een kristallijn materiaal hadden gemaakt dat zuurstof uit de lucht kan halen, het kan opslaan en vervolgens naar behoefte kan afgeven. Tien liter van het materiaal kan alle lucht uit een kamer zuigen. Kobalt is een essentieel onderdeel van dit kristal.