Waterstof
Inhoudsopgave
Beschrijving
Waterstof (symbool H, atoomnummer 1) is een chemische element en het meest voorkomende en lichtste van alle elementen. Ongeveer 75% van de elementaire massa van het heelal is waterstof. Waterstof in de vorm van plasma is het belangrijkste element in de samenstelling van sterren die zich op de hoofdreeks bevinden. Op Aarde komt waterstof van nature weinig voor. Het is het hoofdelement van alle organische materie en water. Op industriële schaal wordt waterstof gemaakt door het met stoom omzetten van methaan. Elektrolyse van water en andere energie-intensieve productietechnieken worden minder vaak gebruikt.
Moleculair waterstof en diwaterstof (waterstofgas) is extreem ontvlambaar. In lucht kan het in verschillende concentraties, van 4% (v/v) tot 75% (v/v) ontbranden. Concentraties van 5 tot 95% vormt samen met chloor een explosief mengsel. Zuivere waterstof-zuurstofvlammen zenden ultraviolet licht uit en dat is nagenoeg onzichtbaar voor het menselijke oog. Om brandende waterstoflekken te vinden is een vlamdetector nodig.
Onder normale omstandigheden is waterstof een smaakloos, kleurloos en geurloos gas dat bestaat uit di-atomaire moleculen. Het waterstof atoom heeft 1 elektron en 1 positron in zijn kern. Het atoomgewicht van waterstof is 1,00797 g/mol. Er zijn drie isotopen van waterstof bekend: deuterium, protium en tritium. Ze kunnen kunstmatig worden gemaakt door verschillende nucleaire reacties en ze komen ook van nature in kleine hoeveelheden voor.
Chemische gegevens
| Symbool | H |
| Volledige naam | Waterstof – Hydrogenium |
| Atoomnummer | 1 |
| Atoommassa (g.mol-1 ) | 1,007825 |
| Groep | Overige niet-metalen |
| Elektronegativiteit (Pauling) | 2,1 |
| Dichtheid (g.cm-3 bij 20 °C) | 0.0899 * 10-3 |
| Smeltpunt (°C) | -259,2 |
| Kookpunt (°C) | -252,8 |
| Vanderwaalsstraal (nm) | 0,12 |
| Ionstraal (nm) | 0,208 (-1) |
| Elektronenschil | 1s1 |
| Eerste ionisatiepotentiaal (kJ.mol-1) | 1311 |
| Ontdekt door | Boyle in 1671, Cavendisch in 1776 |
Bohr-Rutherford diagram
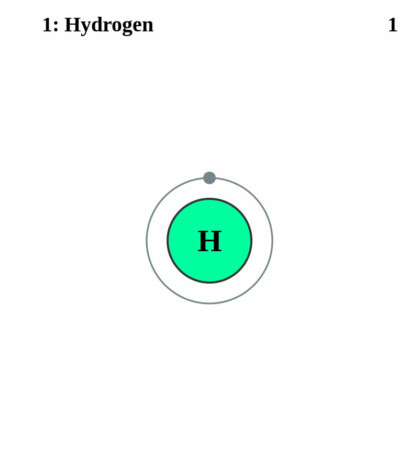
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|
| Waterstof | 1 H | 1,007825 | 99,9885 |
| Deuterium | 2 H | 2,014102 | 0,0115 |
| Tritium | 3 H | 3,016049 | * |
Radioactieve isotopen
| Symbool | Atoommassa | Halfwaardetijd |
|---|---|---|
| 3 H | 3,016049 | 12,32 jaar |
| 4 H | 4,027806 | 1,39 * 10-22 s |
| 5 H | 5,035311 | > 9,1 * 10-22 s |
| 6 H | 6,044943 | 2,9 * 10-ss s |
| 7 H | 7,052749 | 2,3 * 10-23 s |
Spectra
Absorptiespectrum
Emissiespectrum
Toepassingen
Waterstof wordt gebruikt bij de synthese van ammoniak. Waterstof wordt ook gebruikt om zwavel te verwijderen en bij het raffineren van brandstoffen in het zogenaamde hydrocracking proces. Om vaste vetten te maken wordt katalytische hydrogenering van onverzadigde oliën toegepast. Ook bij de productie van organische chemische producten wordt hydrogenering toegepast. Waterstof kan ook gebruikt worden als brandstof voor verbrandingsmotoren.
Wetenschappers kijken naar het toepassen van waterstof in brandstofcellen als een mogelijke manier om energie op te wekken en op te slaan. Zo kan waterstof bijvoorbeeld worden omgezet naar diesel, aardgas en biobrandstoffen. In theorie zou er geen emissie zijn van giftige chemicaliën en CO2.
Grote hoeveelheden waterstof worden, in combinatie bij zuurstof, ook gebruikt als raketbrandstof.
Gezondheid
Waterstof is licht ontvlambaar. Explosies kunnen door verschillende reacties worden veroorzaakt en bij verschillende lucht-gas verhoudingen plaatsvinden. Waterstof kan door inademing in het lichaam worden opgenomen en hoge concentraties waterstof zorgen voor een zuurstofarme omgeving. Mensen die teveel waterstof inademen kunnen verschillende symptomen vertonen waaronder bewusteloosheid, duizeligheid, suizende oren, hoofdpijn, overgeven, misselijkheid en verlies van alle zintuigen.
De huid van slachtoffers kan blauw verkleuren en in sommige gevallen kan het leiden tot de dood.
Waterstof is niet teratogeen of mutageen maar het kan wel reeds bestaande ademhalingsproblemen verergeren als er een blootstelling aan teveel waterstof heeft plaatsgevonden.
Als waterstof in grotere hoeveelheden vrijkomt dan wordt er vrij snel een gevaarlijke situatie bereikt. Zuurstofarme omgevingen zijn een bedreiging voor het leven van dieren maar het plantenleven wordt er niet negatief door beïnvloed.
Ontdekking
Waterstof is in 1776 ontdekt door Henry Cavendish.