Thallium
Inhoudsopgave
Herkomst naam
Thallium is vernoemd naar het Griekse woord “thallos”, en dat betekent groene scheut of takje. Het element is vernoemd naar zijn groene spectraallijn.
Ontdekking
Thallium werd in 1861 spectroscopisch ontdekt door de Britse wetenschapper William Crookes. In 1862 werd het, onafhankelijk van elkaar, door Crookes en de Franse chemicus Claude Auguste Lamy geïsoleerd.
Eigenschappen
Thallium is een kneedbaar en zacht element dat met een mes kan worden gesneden. Het heeft een metaalglans die bij blootstelling aan lucht snel verkleurt tot een blauwgroene kleur.
Van nature komen er twee isotopen van thallium voor en zijn er meer dan 25 radioisotopen bekend.
Thallium is een giftig metaal en het mag niet in direct contact komen met de huid. Men vermoedt dat thallium ook carcinogeen is.
Chemische gegevens
| Symbool | Tl |
| Volledige naam | Thallium |
| Atoomnummer | 81 |
| Atoommassa (g.mol-1 ) | 204,38 |
| Groep | post-transitiemetaal |
| Elektronegativiteit (Pauling) | 1,62 |
| Dichtheid (g.cm-3 bij 20 °C) | 11,85 |
| Smeltpunt (°C) | 304 |
| Kookpunt (°C) | 1473 |
| Vanderwaalsstraal (nm) | 196 |
| Ionstraal (nm) | 99 |
| Isotopen | |
| Elektronenschil | [Xe]4f145d106s26p1 |
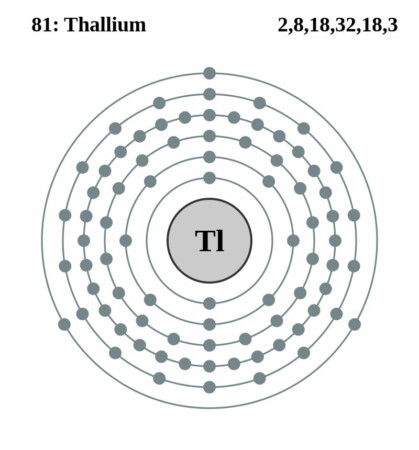
| Elektronen per schil | 2, 8, 18, 32, 18, 3 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 589,4 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1971 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2878 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1861 door William Crookes |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 81 | Thallium | 203 Tl | 202,972329 | 29,524 |
| 205 Tl | 204,974412 | 70,1476 |
radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 176Tl | 176,00059 | 5,2 ms |
| 177Tl | 176,99642 | 18 ms |
| 178Tl | 177,99490 | 255 ms |
| 179Tl | 178,99109 | 270 ms |
| 180Tl | 179,98991 | 1,5 s |
| 181Tl | 180,98625 | 3,2 s |
| 182Tl | 181,98567 | 2,0 s |
| 183Tl | 182,98219 | 6,9 s |
| 184Tl | 183,98187 | 9,7 s |
| 185Tl | 184,97879 | 19,5 s |
| 186Tl | 185,97833 | 40 s |
| 187Tl | 186,97590 | ± 51 s |
| 188Tl | 187,97601 | 71 s |
| 189Tl | 188,97358 | 2,3 min |
| 190Tl | 189,97388 | 2,6 min |
| 191Tl | 190,97178 | 20 min |
| 192Tl | 191,97223 | 9,6 min |
| 193Tl | 192,97067 | 21,6 min |
| 194Tl | 193,97120 | 33,0 min |
| 195Tl | 194,96977 | 1,16 uur |
| 196Tl | 195,97048 | 1,84 uur |
| 197Tl | 196,96957 | 2,84 uur |
| 198Tl | 197,97048 | 5,3 uur |
| 199Tl | 198,96988 | 7,42 uur |
| 200Tl | 199,97096 | 26,1 uur |
| 201Tl | 200,97081 | 72,912 uur |
| 202Tl | 201,97210 | 12,23 dagen |
| 204Tl | 203,97386 | 3,78 jaar |
| 206Tl | 205,97611 | 4,200 min |
| 207Tl | 206,97741 | 4,77 min |
| 208Tl | 207,98201 | 3,053 min |
| 209Tl | 208,98535 | 2,161 min |
| 210Tl | 209,99007 | 1,30 min |
| 211Tl | 210,99348 | 1 min |
| 212Tl | 211,99823 | 30 s |
Bronnen van thallium
Thallium wordt als element aangetroffen in de mineralen crooksiet, lorandiet en hutchinsoniet. Het wordt ook als sporenelement aangetroffen in ijzerpyriet. Uit dit erts kan het door middel van roosteren worden gewonnen. Kleine hoeveelheden thallium komen ook voor in de mangaanknollen op de bodem van de oceaan.
Toepassingen van thallium
- Thallium wordt gebruikt in fotoresistors, optische infraroodapparatuur, laagsmeltende glassoorten en diverse andere toepassingen.
- Thalliumsulfaat werd lage tijd gebruikt als knaagdier- en mierenverdelger maar het is vanwege zijn giftigheid inmiddels in grote delen van de wereld verboden.
- Thalliumzouten zijn ook gebruikt bij de behandeling van huidziekten maar de hoge mate van toxiciteit in vergelijking met de therapeutische voordelen beperkte de medicinale toepassingen ervan.