Thulium
Inhoudsopgave
Wat is Thulium?
Thulium heeft atoomnummer 69 en symbool Tm. Het behoort tot de zeldzame aardmetalen. Thulium werd in 1789 door de chemicus Per Theodor Cleve geïsoleerd. Het was dezelfde methode als waarmee ook de elementen terbium, erbium en lanthaan werden geïsoleerd. Het duurde tot 1911 alvorens men thulium in pure vorm wist te zuiveren. Thulium is een zeldzaam en duur element dat tot de groep van de lanthaniden behoort.
Gegevens
| Symbool | Tm |
| Volledige naam | Thulium |
| Atoomnummer | 69 |
| Atoommassa (g.mol-1 ) | 168,934 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 9,3 |
| Smeltpunt (°C) | 1545 |
| Kookpunt (°C) | 1947 |
| Vanderwaalstraal (nm) | — |
| Ionstraal (nm) | — |
| Isotopen | 1 |
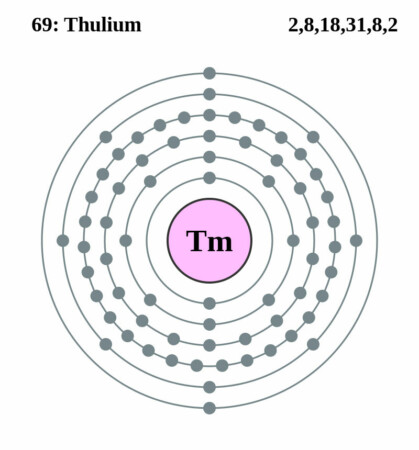
| Elektronenconfiguratie | [Xe]4f136s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 595,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1160,7 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2284 |
| Standaard potentiaal (V) | -2,28 |
| Ontdekt door | Per Teodor Cleve in 1879 |
Bohr-Rutherford diagram
Eigenschappen, isotopen en verbindingen
Thulium is taai en buigzaam en het heeft een zilverwitte kleur. Het element is bij kamertemperatuur vast. Het heeft een kookpunt van 1947 °C en een smeltpunt van 1545 °C. In vloeibare vorm is het vluchtig en het vervaagt bij blootstelling aan de lucht en aan water. Het isotoop met de grootste halfwaardetijd is Tm-69. Er zijn 5 isotopen bekend: 170Tm, 171Tm, 169Tm, 178Tm en 167Tm.
Het element reageert met zoutzuur, halogenen, metalen en niet-metalen en vormt verbindingen als trimedoxinebromide, thuliumnitride en anderen. Als thulium reageert met chalcogenen als astatine, jodium, broom, chloor en fluor dan ontstaan er chalcogeniden. Deze elementen hebben allemaal vergelijkbare eigenschappen. De verbindingen hebben allemaal een gele of witte kleur. Thuliumhydroxide en waterstofgas ontstaan als water reageert met thuliumdichloride. Het enige oxide van thulium is thuliumoxide.
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 69 | Thulium | 169 Tm | 168,934211 | 100 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 146Tm | 145,96643 | 240 ms |
| 147Tm | 146,96096 | 0,58 s |
| 148Tm | 147,95784 | 0,7 s |
| 149Tm | 148,95272 | 0,9 s |
| 150Tm | 149,94996 | 3 s |
| 151Tm | 150,94548 | 4,17 s |
| 152Tm | 151,94442 | 8,0 s |
| 153Tm | 152,94201 | 1,48 s |
| 154Tm | 153,94156 | 8,1 s |
| 155Tm | 154,93919 | 21,6 s |
| 156Tm | 155,93898 | 83,8 s |
| 157Tm | 156,93697 | 3,63 min |
| 158Tm | 157,93698 | 3,98 min |
| 159Tm | 158,93498 | 9,13 min |
| 160Tm | 159,93526 | 9,4 min |
| 161Tm | 160,93355 | 30,2 min |
| 162Tm | 161,93399 | 21,70 min |
| 163Tm | 162,93265 | 1,810 uur |
| 164Tm | 163,93356 | 2,0 min |
| 165Tm | 164,93243 | 30,06 uur |
| 166Tm | 165,93355 | 7,70 uur |
| 167Tm | 166,93285 | 9,25 dagen |
| 168Tm | 167,93417 | 93,1 dagen |
| 170Tm | 169,93580 | 128,6 dagen |
| 171Tm | 170,93642 | 1,92 jaar |
| 172Tm | 171,93840 | 63,6 uur |
| 173Tm | 172,93960 | 8,24 uur |
| 174Tm | 173,94217 | 5,4 min |
| 175Tm | 174,94384 | 15,2 min |
| 176Tm | 175,94699 | 1,85 min |
| 177Tm | 176,94904 | 90 s |
| 178Tm | 177,95264 | 30 s |
| 179Tm | 178,95534 | 20 s |
Voorkomen, geschatte reserves & extractietechnieken
Thulium wordt gevonden in landen als de Verenigde Staten, Tanzania, India, Groenland en Australië. De grootste afzettingen bevinden zich in China. Brazilië, Rusland en China zijn de grootste producenten. De totale wereldreserve wordt geschat op 100.000 ton. Het element komt niet vrij in de natuur voor maar alleen in mineralen die ook gadolinium en yttrium bevatten. Het komt ook voor in mineralen als euxeniet, xenotiem, monaziet en gadoliniet. De belangrijkste extractiemethodes zijn solvent extractie en ionenuitwisseling. Ook reductie met calcium wordt toegepast.
Commerciële toepassingen
Thulium wordt toegepast in de meteorologie en medicijnen. Ook wordt het gebruikt in röntgenapparaten, stralingsmeters en lasers. Röntgenapparaten die thulium bevatten zijn licht en draagbaar. Een van de isotopen, Tm-170, wordt gebruikt in de brachytherapie (inwendige bestraling bijvoorbeeld bij prostaat-, huid- en borstkanker). Brachytherapie wordt vaak samen gebruikt met chemotherapie.
Er zijn geen commercieel interessante verbindingen van thulium bekend. Thulium is duur en het werd voornamelijk voor onderzoeksdoeleinden gebruikt. Het element wordt soms toegevoegd aan boogverlichting en aan hoge-temperatuur supergeleiders.
Gezondheid & milieueffecten
Thulium heeft geen biologische functie in het menselijk lichaam. Oplosbare zouten van thulium kunnen het metabolisme versnellen. Onoplosbare zouten zijn niet giftig en veilig terwijl oplosbare zouten licht giftig zijn. Het element is niet gevaarlijk voor planten en dieren en het wordt dus als onschadelijk oor het milieu beschouwd.