Chroom
Inhoudsopgave
Chroom is bekend om zijn zilveren, glanzende uiterlijk. Het wordt daarom gebruikt om auto’s, kachels en andere apparaten te coaten om ze te beschermen tegen corrosie en om hun uiterlijk te verbeteren. Het hoge smeltpunt en de stabiele structuur van chroom maken het ook bruikbaar in de textiel- en de vuurvaste industrie. In combinatie met andere elementen maakt chroom levendige kleuren en wordt het gebruikt als kleurstof. Hier is de oorspronkelijke naam van afkomstig. Chroom stamt af van het Griekse woord “chroma” en dat betekent “kleur”.
Het wordt van nature aangetroffen in verbindingen in de aardkorst. Het consumeren van hoge niveaus chroom in vervuild drinkwater of het inademen van dampen van het verwarmde element kan echter leiden tot maagzweren, kanker en andere gezondheidsproblemen.
Chemische gegevens
| Symbool | Cr |
| Volledige naam | Chromium, Chroom |
| Atoomnummer | 24 |
| Atoommassa (g.mol-1 ) | 51,9961 |
| Groep | transitiemetaal |
| Elektronegativiteit (Pauling) | 1.65 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,19 |
| Smeltpunt (°C) | 1907 |
| Kookpunt (°C) | 2671 |
| Vanderwaalsstraal (nm) | 0,127 |
| Ionstraal (nm) | 0,061 (+3), 0,044 (+6) |
| Isotopen | 4 stabiel |
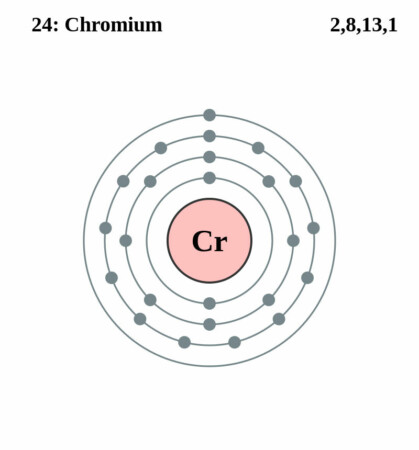
| Elektronenschil | [Ar]3d54s1 |
| Elektronen per schil | 2, 8, 13, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 652,9 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1590,6 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2987 |
| Standaard potentiaal (V) | -0,71 (Cr3+ /Cr) |
| Ontdekt door: | 1797 door Louis Nicolas Vauquelin |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 24 | Chroom | 50 Cr | 49,946050 | 4,345 |
| 52 Cr | 51,940512 | 83,789 | ||
| 53 Cr | 52,940654 | 9,501 | ||
| 54 Cr | 53,938885 | 2,365 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
| 44 Cr | 43,98555 | 54 ms |
| 45 Cr | 44,97964 | 50 ms |
| 46 Cr | 45,968359 | 0,26 s |
| 47 Cr | 46,962900 | 500 ms |
| 48 Cr | 47,954032 | 21,56 uur |
| 49 Cr | 48,9513357 | 42,3 min |
| 51 Cr | 50,9447674 | 27,7025 d |
| 55 Cr | 54,9408397 | 3,497 min |
| 56 Cr | 55,9406531 | 5,94 min |
| 57 Cr | 56,943613 | 21,1 s |
| 58 Cr | 57,94435 | 7,0 s |
| 59 Cr | 58,94859 | 460 ms |
| 60 Cr | 59,95008 | 560 ms |
Ontdekking van chroom
In 1797 was het de Franse chemicus Louis Nicolas Vauquelin die als eerste chroom isoleerde uit een felrood mineraal dat Siberisch Rood werd genoemd. We kennen het tegenwoordig als loodchromaat (PbCrO4). Het duurde een jaar voordat Vauquelin in staat was om het lood neer te slaan en zuiver chroom te verkrijgen. Hij mengde chroom in een verscheidenheid aan oplossingen waardoor er allerlei kleuren ontstonden en hij het element vernoemde naar het Griekse woord “chromame” wat “kleur” betekent.
Bronnen van chroom
Chroom is het 21st meest voorkomende element in de korst van de Aarde maar het komt niet in vrije vorm voor. Chroom wordt voornamelijk als chromieterts gewonnen. Dit chromiet wordt hoofdzakelijk gevonden in Zimbabwe, Rusland, Nieuw-Zeeland, Turkije, Iran, Albanië, Finland, de Filippijnen en Madagaskar. Jaarlijks wordt er ongeveer 20.000 ton chroom geproduceerd. In de Verenigde Staten , Groenland en Canada bevindt zich nog een winbare voorraad van ongeveer een miljard ton. Chroom wordt uit chromiet gewonnen door het te verhitten in aanwezigheid van aluminium of silicium.
Eigenschappen van chroom
Chroom is een transitiemetaal. In zijn pure vorm is het een zilverachtig, glanzend en hard metaal dat ideaal is voor galvaniseren.
De belangrijkste chroomverbindingen zijn de chromaten van natrium en kalium, de dichromaten en ammoniumchroomalums. Chroomverbindingen zijn giftig en moeten met zorg worden behandeld.
Chroomverbindingen hebben allemaal heldere, sprankelende kleuren en ze worden gebruikt als pigmenten. Ze zijn heldergroen, geel, rood of oranje. Robijnen zijn rood vanwege chroom en glas dat met chroom wordt behandeld heeft een smaragdgroene kleur.
Gebruikt voor bescherming en schoonheid
Met behulp van een techniek die galvaniseren wordt genoemd kan een dunne laag chroom worden aangebracht op metalen en plastic voorwerpen waaronder auto-onderdelen en huishoudelijke apparaten. Dit zorgt voor een glanzende afwerking die het voorwerp aantrekkelijker maakt. Auto-ontwerpers gebruiken bijvoorbeeld chromen velgen en wielen om auto’s op te fleuren. Verchromen wordt niet alleen gedaan om de looks. Chroom zorgt ook voor een beschermend oxidelaagje op het oppervlak. Verchroomde onderdelen zijn daarom corrosiebestendig.
Roestvast staal is een legering van ijzer met minimaal 10,5% chroom. Het is zeer goed bestand tegen corrosie. Het wordt gebruikt in keukenbestek, apparaten en kookgerei zoals roestvrijstalen pannen en ketels.
Ongeveer 90% van het leer wordt gelooid met chroom. Tijdens dit proces wordt chroomsulfaat gebruikt om de huid van dieren te behandelen en er leer van te maken dat bestand is tegen heet water dat degradatie kan veroorzaken.
Ovens gebruiken vaak stenen die zijn gemaakt van chromieterts. Dit zorgt ervoor dat ze hun sterkte behouden bij hoge temperaturen. De textielindustrie gebruikt chroomionen om kleurstoffen aan textiel te laten hechten. Het hoge smeltpunt van chroom, de gematigde thermische uitzetting en de kristallijne structuurstabiliteit maken het geschikt voor vele doeleinden.
Bij overmaat gevaarlijk
Hoewel de specifieke rol van chroom bij mensen niet duidelijk is hebben onderzoeken wel aangetoond dat chroom een essentieel sporenelement is dat wordt aangetroffen in RNA en het lichaam helpt om glucose te gebruiken. Chroom wordt het meest geconcentreerd aangetroffen in de placenta en de aanwezigheid ervan in het lichaam neemt af met het toenemen van de leeftijd.
Een veilige dagelijkse hoeveelheid is 1 milligram. Voedingsmiddelen zoals biergist, tarwekiemen en niertjes zijn rijk aan chroom. Bij overmaat is chroom echter giftig.
Een overmatige blootstelling aan chroom kan ook leiden tot maagzweren. Die treden op na maandenlang werken tijdens verchromen of leerlooien. Chroomzweren zijn jeukende en rauwe gaten in de huid of de maag. Als stof chroom bevat en dat stof wordt ingeademd dan zijn industriële arbeiders vatbaarder voor zweren in de neusholte en longkanker. Hoge niveaus van chroom in urine worden in verband gebracht met hart- en vaatziekten en diabetes.