Broom
Inhoudsopgave
Stinkend element nr. 35 Broom is een element dat redelijk veel voorkomt maar dat wel een zeldzame eigenschap heeft: het is het enige niet-metaal dat bij kamertemperatuur in vloeibare vorm voorkomt en een van de slechts twee elementen (het andere is kwik) dat bij kamertemperatuur en druk vloeibaar is.
Het is het 44ste meest voorkomende element in de aardkorst. De aardkorst bevat gemiddeld 2,4 ppm broom. Broom komt voor in verbindingen in zeewater, natuurlijke pekel en indampresten van zoutmeren. De wereldwijde productie van broom wordt geschat op ongeveer 330.000 ton per jaar. Broommineralen worden o.a. gewonnen in de Verenigde Staten, Israël, Rusland, Frankrijk en Japan.
Broom is erg schadelijk voor de atmosfeer. Broomatomen zijn 40 tot 400 keer meer destructief in de ozonlaag dan chlooratomen. Ongeveer de helft van het ozonverlies boven Antarctica is toe te schrijven aan reacties met broom. Methylbromide, gebruikt als ontsmettingsmiddel, is de grootste bron van ozonafbrekend broom. Ongeveer 30% van het broom in de atmosfeer is afkomstig van menselijke activiteiten, de rest is natuurlijk.
Chemische gegevens
| Symbool | Br |
| Volledige naam | Broom |
| Atoomnummer | 35 |
| Atoommassa (g.mol-1 ) | 79,904 |
| Groep | halogenen |
| Elektronegativiteit (Pauling) | 2,96 |
| Dichtheid (g.cm-3 bij 20 °C) | 3,1028 |
| Smeltpunt (°C) | -7,2 |
| Kookpunt (°C) | 58,8 |
| Vanderwaalsstraal (nm) | 0,165 |
| Ionstraal (nm) | 0,195 (-1) |
| Isotopen | 10 |
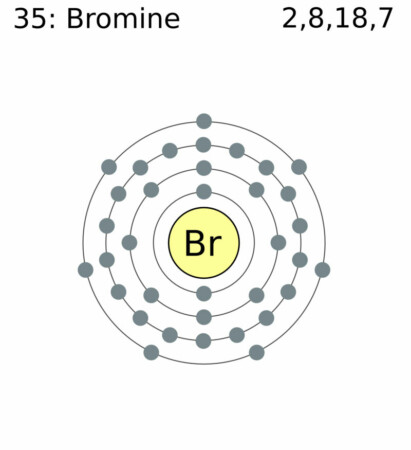
| Elektronenschil | [Ar]3d104s24p5 |
| Elektronen per schil | 2, 8, 18, 7 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1139,9 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 2103 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3470 |
| Standaard potentiaal (V) | 1,08 |
| Ontdekt door: | 1825 door Carl Jacob Löwig en Antone jérôme Balard |
Bohr – Rutherford diagram
CC BY-SA 2.0 uk, Link
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 35 | Broom | 79 Br | 78,918338 | 50,69 |
| 81 Br | 80,916291 | 49,31 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 69Br | 68,95011 | < 24 ns |
| 70Br | 69,94479 | 79,1 ms |
| 71Br | 70,93874 | 21,4 s |
| 72Br | 71,93664 | 78,6 s |
| 73Br | 72,93169 | 3,4 min |
| 74Br | 73,92989 | 25,4 min |
| 75Br | 74,92577 | 96,7 min |
| 76Br | 75,92454 | 16,2 uur |
| 77Br | 76,92137 | 57,036 uur |
| 78Br | 77,92114 | 6,46 min |
| 80Br | 79,91852 | 17,68 min |
| 82Br | 81,91680 | 35,282 uur |
| 83Br | 82,91518 | 2,40 uur |
| 84Br | 83,91647 | 31,80 min |
| 85Br | 84,91560 | 2,90 min |
| 86Br | 85,91879 | 55,1 s |
| 87Br | 86,92071 | 55,65 s |
| 88Br | 87,92407 | 16,29 s |
| 89Br | 88,92639 | 4,40 s |
| 90Br | 89,93063 | 1,91 s |
| 91Br | 90,93397 | 541 ms |
| 92Br | 91,93926 | 0,343 s |
| 93Br | 92,94305 | 102 ms |
| 94Br | 93,94868 | 70 ms |
| 95Br | 94,95287 | 50 ms |
| 96Br | 95,95853 | 20 ms |
| 97Br | 96,96280 | 10 ms |
Geschiedenis
Broom is onafhankelijk van elkaar door twee chemici ontdekt.
In 1825 isoleerde Carl Löwig, een Duitse chemiestudent onder Leopold Gmelin, vloeibaar broom door aan een watermonster uit een zoutbron in Bad Kreuznach chloor toe te voegen. Nadat hij de oplossing uitschudde met ether ontdekte Löwig een roodbruine substantie in de oplossing. Hij isoleerde die door de ether te verdampen. Gmelin adviseerde zijn student om meer van de substantie te produceren zodat die beter bestudeerd kon worden. Tegen de tijd dat Löwig meer van de substantie had geproduceerd, nadat hij vertraging had opgelopen vanwege examen in de winter en vakanties, hadden andere wetenschappers zijn bevindingen al gepubliceerd.
Die andere wetenschapper was de Franse chemicus Antoine-Jérôme Balard. Hij isoleerde broom toen hij bruin zeewier bestudeerde. Balard nam een monster van de pekel waarin het zeewier was aangetroffen en destilleerde het mengsel van pekel met chloor om zo een donkerrode vloeistof te produceren. Oorspronkelijk dacht hij dat het een chloor- of jodiumverbinding was maar toen hij geen van beide elementen kon isoleren stelde hij voor dat hij in feite een nieuw element had gevonden. Balard stelde de naam muride voor, van het Latijnse woord “muria” of pekel voor zijn nieuwe element. Zijn resultaten werden in 1826 gepubliceerd.
Weetjes
Broom is een halogeen. Halogeenelementen (fluor, chloor, broom, jood en astatine) worden nooit alleen in de natuur aangetroffen en ze produceren zouten wanneer ze reageren met metalen.
De naam broom komt van het Griekse woord “bromos” voor stank. De roodbruine vloeistof verdampt gemakkelijk tot een rode damp met een sterke geur die op chloor lijkt.
Broom is gevaarlijk. Het is in vloeibare vorm corrosief voor menselijk weefsel, irriterend voor de ogen en de keel en zeer giftig bij inademing van dampen. Broom beschadigt veel belangrijke organen waaronder de lever, nieren, longen en maag en het kan in sommige gevallen kanker veroorzaken.
Broom kan in het lichaam worden opgenomen via besmet water en voedsel, inademing en opname door de huis.
Broom kan in combinatie met kalium, fosfor en tin spontane ontbranding veroorzaken. Ook reageert met heftig met veel andere chemische verbindingen.
Broom kent een grote verscheidenheid aan toepassingen waaronder in landbouwchemicaliën, insecticiden, kleurstoffen, farmaceutische producten, vlamvertragers, meubelschuim, benzine, plastic behuizingen voor elektronica en filmfotografie.
Broom wordt gebruikt om water te zuiveren, in medicijnen en als ontsmettingsmiddel.
Broom kan ook gebruikt worden om de uitstoot van kwik door kolencentrales tot 90% te verminderen. Broom wordt aan het proces toegevoegd, oxideert kwik waardoor het gemakkelijker kan worden teruggewonnen.
Vanwege de toxiciteit en de gevaren voor het milieu wordt het gebruik van broom als brandvertragers en in de landbouw geleidelijk beëindigd.
Oude beschavingen produceerden een dure paarse vloeistof uit organische bromverbindingen die werden afgescheiden door een zeemossel.
Het menselijk lichaam bevat ongeveer 0,0004% broom. Er zijn geen toepassingen van broom in het menselijk lichaam bekend.