Lutetium
Inhoudsopgave
Wat is Lutetium?
Lutetium is het laatste element in het rijtje lanthaniden, de zeldzame aardmetalen. Lutetium is vernoemd naar lanthanium, het eerste element van de serie. Deze elementen hebben allemaal veel eigenschappen met elkaar gemeen. Lutetium is het laatste element van de lanthaniden en dus ook het element met de grootste dichtheid in deze groep.
Lutetium maakt deel uit van de d-blok in het periodiek systeem, de andere lanthaniden bevinden zich in het f-blok. Lutetium is oplosbaar in water en het vormt met watermoleculen een verbinding.
Lutetium heeft atoomnummer 71 en symbool Lu. Het werd in 1907 onafhankelijk van elkaar ontdekt in Frankrijk, Oostenrijk en Amerika ontdekt.
Gegevens
| Symbool | Lu |
| Volledige naam | Lutetium |
| Atoomnummer | 71 |
| Atoommassa (g.mol-1 ) | 194,967 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 9,7 |
| Smeltpunt (°C) | 1663 |
| Kookpunt (°C) | 3395 |
| Vanderwaalstraal (nm) | |
| Ionstraal (nm) | |
| Isotopen | 34, waarvan 33 radioactief |
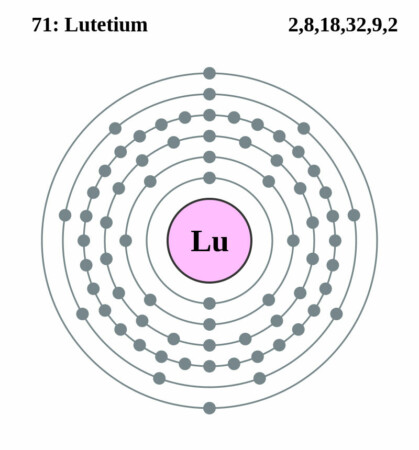
| Elektronenconfiguratie | [Xe]4f145d16s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 522,7 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1339 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2022,29 |
| Standaard potentiaal (V) | -2,25 |
| Ontdekt door | Georges Urbain en Carl Auer von Welsbach in 1907 |
Bohr – Rutherford diagram
Uiteindelijk werd bepaald dat de ontdekking in Frankrijk door Georges Urbain net wat eerder was dan de andere twee en kreeg hij de eer van de ontdekking. Hij noemde het element Lutecium. In 1949 werd de spelling een beetje veranderd en werd het lutetium. Eerdere sporen van het element werden ook aangetroffen in het mineraal ytterbia maar het werd als een onafhankelijk element benoemd. Voorheen dacht men dat het mineraal ytterbia volledig uit het element ytterbium bestond.
Een lutetiumatoom heeft 71 elektronen. Tijdens een chemische reactie zullen de twee elektronen die het verst van de kern zijn verwijderd en het d5 elektron worden verwijderd. Een van de eigenaardigheden van de lanthaniden is dat de grootte van het atoom afneemt naarmate het atoomnummer toeneemt. Dit betekent dat lutetiumaromen kleiner zijn dan alle andere lanthaniden.
Lutetium heeft een zilverwitte kleur en het is bestand tegen corrosie. In de natuur komen er twee isotopen voor: 175Lu en 176Lu. Het eerste isotoop is stabiel en het tweede isotoop heeft een halfwaardetijd van maar liefst 3,78 * 1010 jaar. Door mensen zijn er 32 verschillende isotopen van lutetium gemaakt. Deze variëren in massa van 149,973 tot 183,961. De radioactieve isotopen van lutetium hebben een halfwaardetijd van minder dan 9 dagen waarvan de meeste een halfwaardetijd hebben van minder dan een half uur.
Toepassingen
Lutetium is zeldzaam en duur en het wordt daarom ook niet veel gebruikt. Lutetium komt in kleine hoeveelheden voor samen met de andere zeldzame aardmetalen maar het is lastig om het element te scheiden. Enkele radioactieve isotopen worden in de nucleaire technologie toegepast om de leeftijd van meteorieten te bepalen.
Lutetium komt vaak samen voor met yttrium en het mengsel wordt gebruikt als katalysator in verschillende reacties maar ook in metaallegeringen.
Een van de isotopen van lutetium wordt ook gebruikt bij de behandeling van tumoren. Lutetium kan ook gebruikt worden in raffinaderijen bij het kraakproces van aardolie. Polymerisatiereacties en hydrogeneringen.
Winning
De belangrijkste gebieden waar lutetium kan worden gewonnen bevinden zich in Australië, Sri Lanka, India, Brazilië, de Verenigde Staten en China. De wereldvoorraad lutetium wordt geschat op ongeveer 200.000 ton. De jaarlijkse productie bedraagt ongeveer 10 ton. Het wordt voornamelijk in de vorm van lutetiumoxide gewonnen.
Gezondheid
Lutetium wordt in de vorm van lutetiumfluoride gebruikt en dit is gevaarlijk bij inademing. Het zuivere lutetium wordt ingeslikt dan leidt dit tot milde vergiftingsverschijnselen. De oplosbare zouten van lutetium zijn niet giftig. Net zoals andere zeldzame aardemetalen is lutetium niet erg gevaarlijk. Dat geldt niet voor verbindingen met lutetium. Metaalstof van het element is explosief en licht ontvlambaar. Lutetium zelf vormt geen gevaar voor plant en dier.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 71 | Lutetium | 175 Lu | 174,940768 | 97,41 |
| 176 Lu | 175,942682 | 2,59 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 150Lu | 149,97323 | 43 ms |
| 151Lu | 150,96758 | 80,6 ms |
| 152Lu | 151,96412 | 650 ms |
| 153Lu | 152,95877 | 0,9 s |
| 154Lu | 153,95752 | 1 s |
| 155Lu | 154,95431 | 68,6 ms |
| 156Lu | 155,95303 | 494 ms |
| 157Lu | 156,95009 | 6,8 s |
| 158Lu | 157,94931 | 10,6 s |
| 159Lu | 158,94663 | 12,1 s |
| 160Lu | 159,94603 | 36,1 s |
| 161Lu | 160,94357 | 77 s |
| 162Lu | 161,94328 | 1,37 min |
| 163Lu | 162,94118 | 3,97 min |
| 164Lu | 163,94134 | 3,14 min |
| 165Lu | 164,93940 | 10,74 min |
| 166Lu | 165,93986 | 2,65 min |
| 167Lu | 166,93827 | 51,5 min |
| 168Lu | 167,93874 | 5,5 min |
| 169Lu | 168,93765 | 34,06 uur |
| 170Lu | 169,93847 | 2,012 dagen |
| 171Lu | 170,93791 | 8,24 dagen |
| 172Lu | 171,93908 | 6,70 dagen |
| 173Lu | 172,93893 | 1,37 jaar |
| 174Lu | 173,94033 | 3,31 jaar |
| 175Lu | 174,94077 | stabiel |
| 176Lu | 175,94268 | 38,5 * 109 jaar |
| 177Lu | 176,94375 | 6,6475 dagen |
| 178Lu | 177,94595 | 28,4 min |
| 179Lu | 178,94732 | 4,59 uur |
| 180Lu | 179,94988 | 5,7 min |
| 181Lu | 180,95197 | 3,5 min |
| 182Lu | 181,95504 | 2,0 min |
| 183Lu | 182,95757 | 58 s |
| 184Lu | 183,96091 | 20 s |