Erbium
Inhoudsopgave
Wat is Erbium?
Erbium is een chemisch element met atoomnummer 58 en symbool Er. Het behoort tot de lanthaniden. Dit is een groep elementen met atoomnummers 57 tot 71 plus scandium en yttrium. De laatste twee zijn geen lanthaniden maar omdat ze overeenkomstige eigenschappen hebben worden ze er wel onder gegroepeerd. De serie wordt ook de zeldzame aardmetalen genoemd. De naam is enigszins misleidend omdat de elementen niet echt zeldzaam zijn. Ze worden zeldzaam genoemd omdat ze zelden in grote, goed winbare hoeveelheden worden gevonden. Erbium komt niet in pure vorm in de natuur voor, het maakt altijd deel uit van andere verbindingen en met samen elementen. In zuivere vorm is erbium een vaste stof en heeft het een zilverwitte kleur.
Gegevens
| Symbool | Er |
| Volledige naam | Erbium |
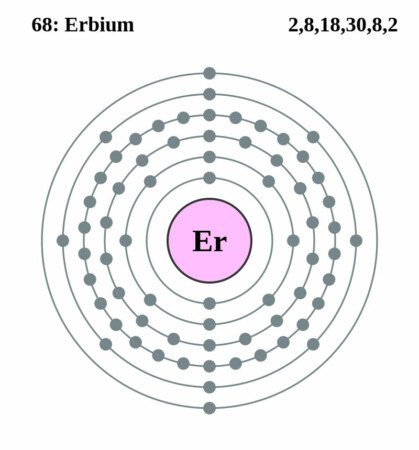
| Atoomnummer | 68 |
| Atoommassa (g.mol-1 ) | 167,26 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 9,2 |
| Smeltpunt (°C) | 1522 |
| Kookpunt (°C) | 2510 |
| vanderwaalstraal (nm) | — |
| Ionstraal (nm) | — |
| Isotopen | 29, waarvan 23 radioactieve isotopen |
| Elektronenconfiguratie | [Xe]4f126s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 587,6 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1149 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2194,09 |
| Standaard potentiaal (V) | -2,30 |
| Ontdekt door | Carl Mosander in 1843 |
Bohr – Rutherford diagram
Erbium werd in een groeve vlakbij de Zweedse plaats Ytterby ontdekt. De Zweedse chemicus Carl Gustaf Mosander scheidde gadoliniet in die verschillende materialen die hij terbia, erbia en yttria noemde. Dit gebeurde in 1843. Vanwege hun overeenkomsten in namen en eigenschappen verwarden wetenschappers al heel snel terbia en erbia. In 1877 werden hun namen omgedraaid. Mosander ontdekte twee elementen in deze twee: erbium en terbium. Erbium wordt tegenwoordig voornamelijk geproduceerd uit de mineralen euxeniet en xenotiem.
Er zijn verschillende applicaties waar Erbium in wordt toegepast zoals in de dermatologie en tandheelkunde. Legeringen van erbium met vanadium zorgen ervoor dat het metaal gemakkelijker is te bewerken en beter aanvoelt. Erbium wordt gebruikt als doteermiddel in optische glasvezels. Het wordt hier dan gebruikt als signaalversterker. Ook in de nucleaire industrie wordt erbium gebruikt.
Erbiumoxide heeft een roze kleur en wordt gebruikt om glas te kleuren. Andere verbindingen met erbium zijn o.a. erbiumchloride, erbiumfluoride en erbiumjodide.
Erbium is een driewaardig element. In zuivere vorm is het gemakkelijk te buigen, zacht maar stabiel e het oxideert niet erg snel. De zouten van erbium hebben een roze kleur. De chemische en fysische eigenschappen zijn afhankelijk van de zuiverheid van het element. Men denkt dat erbium het menselijke metabolisme versmelt.
Afhankelijk van de temperatuur is het element ferromagnetisch, antiferromagnetisch en paramagnetisch. Het heeft deze eigenschappen achtereenvolgens bij een temperatuur van < 19 Kelvin, tussen 19 en 80 Kelvin en > 80 Kelvin.
Bij contact met lucht brandt het metaal erbium. Er ontstaat dan erbium(III)oxide. Met koud water vindt er een langzame reactie plaats maar in heet water verloopt de reactie erg snel. Er ontstaat dan erbiumhydroxide. Erbium reageert met halogenen en lost gemakkelijk op in verdund zwavelzuur. Er bestaan 6 stabiele isotopen: Er-162, Er-164, Er-166, Er-167, Er-168 en Er-170. In de natuur is Er-166 het meest voorkomende isotoop. Van de radioactieve isotopen heeft Er-169 de grootste halfwaardetijd: 9,4 dagen.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 68 | Erbium | 162 Er | 161,928775 | 0,14 |
| 164 Er | 163,929197 | 1,61 | ||
| 166 Er | 165,930290 | 33,61 | ||
| 167 Er | 166,932045 | 22,93 | ||
| 168 Er | 167,932368 | 26,78 | ||
| 170 Er | 169,935460 | 14,93 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 143Er | 142,96634 | 200 ms |
| 144Er | 143,96038 | 400 ms |
| 145Er | 144,95739 | 900 ms |
| 146Er | 145,95200 | 1,7 s |
| 147Er | 146,94949 | ± 2,5 s |
| 148Er | 147,94455 | 4,6 s |
| 149Er | 148,94231 | 4 s |
| 150Er | 149,93791 | 18,5 s |
| 151Er | 150,93744 | 23,5 s |
| 152Er | 151,93505 | 10,3 s |
| 153Er | 152,93506 | 37,1 s |
| 154Er | 153,93278 | 3,73 min |
| 155Er | 154,93320 | 5,3 min |
| 156Er | 155,93106 | 19,5 min |
| 157Er | 156,93192 | 18,65 min |
| 158Er | 157,92989 | 2,29 uur |
| 159Er | 158,93068 | 36 min |
| 160Er | 159,92908 | 28,58 uur |
| 161Er | 160,92999 | 3,21 uur |
| 163Er | 162,93003 | 75,0 min |
| 165Er | 164,93072 | 10,36 uur |
| 169Er | 168,93459 | 9,392 dagen |
| 171Er | 170,93802 | 7,516 uur |
| 172Er | 171,93935 | 49,3 uur |
| 173Er | 172,94240 | 1,434 min |
| 174Er | 173,94423 | 3,2 min |
| 175Er | 174,94777 | 1,2 min |
| 176Er | 175,95008 | 20 s |
| 177Er | 176,95405 | 3 s |