Cesium
Inhoudsopgave
Cesium is een zeldzaam, zilverwit, glanzend metaal dat mooi blauwe spectraallijnen heeft. De naam van het element van van “caesius” een Latijns woord voor “hemelsblauw”. Het is het zachtste metaal dat bij kamertemperatuur als was aanvoelt. Het zou in je handen smelten als het niet door het vocht zou exploderen.
Cesium is een natuurlijk voorkomend element maar het komt maar zelden in zuivere vorm voor. Het is erg reactief en vormt heel gemakkelijk verbindingen. Cesium heeft een dichtheid van bijna tweemaal die van water en het is een taai element.
Chemische gegevens
| Symbool | Cs |
| Volledige naam | Cesium |
| Atoomnummer | 55 |
| Atoommassa (g.mol-1 ) | 132,90 |
| Groep | Alkalimetalen |
| Elektronegativiteit (Pauling) | 0,79 |
| Dichtheid (g.cm-3 bij 20 °C) | 1.879 |
| Smeltpunt (°C) | 28,4 |
| Kookpunt (°C) | 671 |
| Vanderwaalstraal (nm) | 0,343 |
| Ionstraal (nm) | 0,167 |
| Isotopen | 1 stabiel |
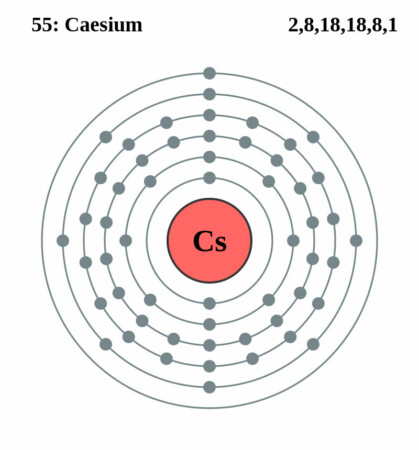
| Elektronen per schil | 2, 8, 18, 18, 1 |
| Elektronenconfiguratie | [Xe]6s1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 375,7 |
| Tweede ionisatie potentiaal (kJ.mol-1 ) | 2234,3 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3400 |
| Standaard potentiaal (V) | — |
| Ontdekt door | 1860 door Robert Bunsen en Gustav Kirchhoff |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 55 | Cesium | 133 Cs | 132,905447 | 100 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 114Cs | 113,94145 | 0,57 s |
| 115Cs | 114,93591 | 1,4 s |
| 116Cs | 115,93337 | 0,70 s |
| 117Cs | 116,92867 | 8,4 s |
| 118Cs | 117,92655 | 14 s |
| 119Cs | 118,92237 | 43,0 s |
| 120Cs | 119,92067 | 61,2 s |
| 121Cs | 120,91722 | 155 s |
| 122Cs | 121,91611 | 21,18 s |
| 123Cs | 122,91299 | 5,88 min |
| 124Cs | 123,91225 | 30,9 s |
| 125Cs | 124,90972 | 46,7 min |
| 126Cs | 125,90945 | 1,64 min |
| 127Cs | 126,90741 | 6,25 uur |
| 128Cs | 127,90774 | 3,640 min |
| 129Cs | 128,90606 | 32,06 uur |
| 130Cs | 129,90670 | 29,21 min |
| 131Cs | 130,90546 | 9,689 dagen |
| 132Cs | 131,90643 | 6,480 dagen |
| 134Cs | 133,90671 | 2,0652 jaar |
| 135Cs | 134,90597 | 2,3 * 106 jaar |
| 136Cs | 135,90731 | 13,16 dagen |
| 137Cs | 136,90708 | 30,1671 jaar |
| 138Cs | 137,91101 | 33,41 min |
| 139Cs | 138,91336 | 9,27 min |
| 140Cs | 139,91728 | 63,7 s |
| 141Cs | 140,92004 | 24,84 s |
| 142Cs | 141,92429 | 1,689 s |
| 143Cs | 142,92735 | 1,791 s |
| 144Cs | 143,93207 | 994 ms |
| 145Cs | 144,93552 | 582 ms |
| 146Cs | 145,94029 | 0,321 s |
| 147Cs | 146,94416 | 0,235 s |
| 148Cs | 147,94922 | 146 ms |
| 149Cs | 148,95293 | 150 ms |
| 150Cs | 149,95817 | 100 ms |
| 151Cs | 150,96219 | 60 ms |
Bohr – Rutherford diagram
Geschiedenis
Cesium was het eerste element dat met behulp van een spectroscoop werd gevonden. Het werd 1860 ontdekt door de Duitse chemici Robert Bunsen en Gustav Kirchhoff toen ze het spectrum van mineraalwater analyseerden.
De eerste toepassingen van cesium kwamen in de jaren ’20 van de vorige eeuw. Cesium werd toen gebruikt om vacuümbuizen te ontdoen van resterende zuurstof. Ook werd het als coating op verwarmde kathodes aangebracht om de elektrische stroom te vergroten. In latere decennia ontstonden meer toepassingen voor cesium zoals gebruik in foto-elektrische cellen, spectrometers en katalysatoren voor organische reacties. Door de hoge kosten van cesium en de groeiende populariteit van vergelijkbare en goedkopere technologieën waarbij andere alkalimetalen worden gebruikt, is het gebruik van cesium teruggelopen tot een handvol toepassingen.
Weetjes
- Cesium is, samen met lithium, natrium, kalium, rubidium en francium, een alkalimetaal. Alkalimetalen zijn zeer reactief, hebben één elektron in hun buitenste schil en ze komen niet vrij voor in de natuur. Deze metalen zijn goed vervormbaar en buigzaam en het zijn goede geleiders van warmte en elektriciteit.
- Cesium is uitermate geschikt voor tijdwaarneming. Het wordt dan ook toegepast in atoomklokken. De officiële definitie van een seconde is de tijd die het cesiumatoom nodig heeft om 9.192.631.770 keer tussen energieniveaus te trillen. Atoomklokken op basis van cesium verliezen één seconde per 100 miljoen jaar.
- Cesium is een van de vier metalen die vloeibaar zijn bij of in de buurt van kamertemperatuur. De andere elementen zijn kwik (smeltpunt -38,8 °C), gallium (smeltpunt 29,8 °C) en francium (smeltpunt 27 °C).
- De aardkorst bevat ongeveer 3 ppm cesium. Voor het zonnestelsel als geheel is dit ongeveer 8 ppb.
- Cesium is sterk reactief en gaat gemakkelijk verbindingen aan met andere elementen en dan in het bijzonder zuurstof en andere gassen en niet-metalen.
- Omdat cesium heftig met water reageert wordt het als een gevaarlijk metaal beschouwt en wordt het meestal bewaard onder een laag minerale olie of in een vacuüm. Cesium reageert ook heftig met zwavel, fosfor, zuren en halogenen (fluor, chloor, broom, jood en astaat).
- Radioactieve isotopen van cesium kunnen op twee manieren worden gemaakt: in een kerncentrale door kernsplijting van uranium in brandstofstaven en bij de explosie van kernwapens.
- Sporen van cesium komen in een aantal mineralen voor. Cesium wordt voornamelijk gewonnen uit polluciet maar ook lepidoliet bevat cesium. Canada en Zimbabwe zijn de grootste leveranciers van cesium.
- Er zijn drie verschillende manieren om cesium te isoleren van de rest van het mineraal: de mineralen oplossen in zuur en vervolgens de zouten scheiden, het mineraal roosteren met een mengsel op basis van calcium of natrium om vervolgens de cesiumzouten te isoleren en directe reductie: het onder vacuüm verhitten van het mineraal in aanwezigheid van calcium, kalium of natrium. Dit levert een onzuiver cesiummetaal op.
- Mensen en dieren worden voortdurend blootgesteld aan kleine hoeveelheden cesium. Dit gebeurt door middel van eten, drinken en inademing. Hoewel het onwaarschijnlijk is dat mensen hierdoor nadelige gezondheidseffecten zullen ondervinden kan blootstelling aan radioactief cesium of bepaalde cesiumverbindingen leiden tot misselijkheid, braken, bloedingen en beschadigingen van lichaamscellen.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30