Silicium
Inhoudsopgave
Wat is silicium?
Silicium heeft atoomnummer 14 en symbool Si. Het is een metalloïde en een chemisch element dat bij kamertemperatuur vast is. Het werd in 1824 voor het eerst geïsoleerd door de Zweedse chemicus Jons Berzelius. Hij identificeerde ook de elementen cerium, thorium en selenium. Silicium is met helium, waterstof, koolstof, stikstof, neon en zuurstof een van de meest voorkomende elementen in het heelal. Silicium is samen met calcium, ijzer, aluminium en zuurstof een van de meest voorkomende elementen in de korst van de Aarde.
Chemische gegevens
| Symbool | Si |
| Volledige naam | Silicium |
| Atoonnummer | 14 |
| Atoommassa (g.mol-1 ) | 28,08566 |
| Groep | Metalloïden |
| Elektronegativiteit (Pauling) | 1,8 |
| Dichtheid (g.cm-3 bij 20 °C) | 2,33 |
| Smeltpunt (°C) | 1410 |
| Kookpunt (°C) | 2355 |
| Vanderwaalstraal (nm) | 0,123 |
| Ionstraal (nm) | 0,271 (-4); 0,041 (+4) |
| Isotopen | 3 |
| Elektronenconfiguratie | [Ne]3s2 3p2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 786,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1576,5 |
| Derder ionisatiepotentiaal (kJ.mol-1 ) | 3228,3 |
| Vierde ionisatiepotentiaal (kJ.mol-1 ) | 4354,4 |
| Ontdekt door | Jöns Jakob Berzelius in 1823 |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 14 | Silicium | 28 Si | 27,976927 | 92,2297 |
| 29 Si | 28,976495 | 4,6832 | ||
| 30 Si | 29,973770 | 3,0872 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 22 Si | 22,03453 | 29 ms |
| 23 Si | 23,02552 | 42,3 ms |
| 24 Si | 24,011546 | 140 ms |
| 25 Si | 25,004106 | 220 ms |
| 26 Si | 25,992330 | 2,234 s |
| 27 Si | 26,98670491 | 4,16 s |
| 31 Si | 30,97536323 | 157,3 min |
| 32 Si | 31,97414808 | 170 jaar |
| 33 Si | 32,978000 | 6,18 s |
| 34 Si | 33,978576 | 2,77 s |
| 35 Si | 34,98458 | 780 ms |
| 36 Si | 35,98660 | 0,45 s |
| 37 Si | 36,99294 | 90 ms |
| 38 Si | 37,99563 | 90 ms |
| 39 Si | 39,00207 | 47,5 ms |
| 40 Si | 40,00587 | 33,0 ms |
| 41 Si | 41,01456 | 20,0 ms |
| 42 Si | 42,01979 | 13 ms |
| 43 Si | 43,02866 | 15 ms |
| 44 Si | 44,03526 | 10 ms |
Bohr-Rutherford diagram
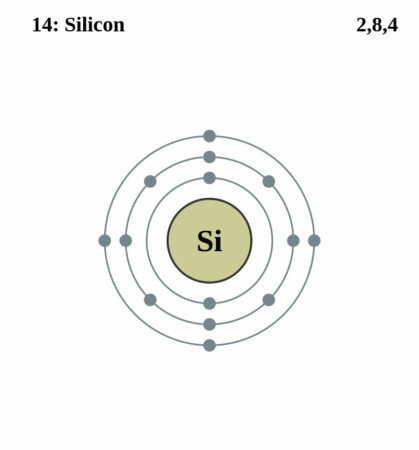
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Spectra
Absorptiespectrum
Emissiespectrum
Eigenschappen en voorkomen
Silicium is een bros en elektropositief element dat een kookpunt van 3265 °C heeft. Er zijn twee allotropen bekend; kristallijn en amorf die beiden een hoog kookpunt en smeltpunt hebben. Het is glanzend en grijs van kleur. De oxidatietoestanden zijn -4, -3, -2, -1, 1, 2, 3 en 4. Er zijn 5 isotopen bekend waarvan Si-30, Si-29 en Si-28 stabiel zijn.
Silicium kan verschillende verbindingen vormen zoals silatrenen, tetrahaliden, disilenen, silaan en anderen. Als silicium wordt gedoteerd met arseen dan ontstaan er kristallen. Dit doteren kan ook gebeuren met fosfor, germanium, gallium en kalium. Om silicium kristallen te laten groeien wordt er gebruikgemaakt van het Czochralski proces.
De grote siliciumproducenten bevinden zich in de Verenigde Staten, Rusland en China. Zuivere silicium komt voor in verschillende mineralen zoals opaal, jaspis, bergkristal, agaat, amethist en kwarts. Amorf opalijn wordt gevonden in sponzen en kiezelwier.. Silicaten en silicium komt veel voor en is niet giftig. Mineralen als kaoliniet, perliet, vermiculiet en olivijn worden middels mijnbouw gewonnen. Sommige types silicium zijn zeldzaam en erg duur. Voorbeelden hiervan zijn microkristallijnen en diamantstimulerende verbindingen zoals bergkristal, agaat, opaal en anderen.
Toepassingen
Silicium wordt toegepast in de elektronica-industrie en in legeringen in de staalindustrie. Het wordt toegevoegd aan legeringen om de kans op scheuren te verminderen. Het element wordt ook gebruikt bij de productie van halfgeleiders en detectoren, fotovoltaïsche toepassingen en wafers.
De verbindingen hebben ook commerciële toepassingen. Natriumsilicaat wordt bijvoorbeeld gebruikt als conserveringsmiddel voor eieren en toegevoegd aan lijmen en zepen. Het wordt ook toegevoegd aan silicium dat wordt gebruikt voor implantaten, isolatoren, polijstmiddelen en smeermiddelen.
Silicium heeft veel toepassingen in de voedsel- en chemische industrie. Zo wordt er siliconenolie toegevoegd aan verschillende soorten voedsel en dranken. Dit wordt gedaan vanwege de chemische inertheid, thermische stabiliteit en wateronoplosbaarheid ervan. Smeerolie en antischuimmiddelen worden in de voedselindustrie. Siliciumdioxide wordt gebruikt bij de productie van micro-elementen, gestructureerde materialen, anti-schuimcomponenten en aerogels. Daarnaast wordt siliciumoxide toegevoegd aan bier, sappen en wijn. Siliciumdioxide wordt ook gebruikt in schoonheidsproducten, thermische beschermingsweefsels en cement.
Het wordt veel gebruikt in de bouw en het wordt toegevoegd aan flessen, optische vezels, porselein en glazen.
Siliconen worden toegevoegd aan reinigingsmiddelen, textielcoatings, hydrofobe afwerkingen en wasverzachters. Het wordt ook toegepast in de papier- en pulpindustrie, elektronica industrie, lijmen, schimmelvorming en in de bouwsector.
Tot slot worden siliconen gebruikt in ramen, afdichtingen en sanitaire voegen. Ze worden toegevoegd aan coatings, hoge temperatuurverven en weerbestendige verven.
Gezondheidseffecten
Silicium is te vinden in de huid en in het bindweefsel. Het is niet giftig maar het kan wel ademhalingsproblemen veroorzaken. Sommige verbindingen, zoals bijvoorbeeld siliciumdioxide, worden als giftig beschouwd. Het komt voor in aerogels, silicagels, pyrogeen kiezelzuur en kwarts.
Langdurige blootstelling aan cristobaliet en kwarts verhoogt de kans op longkanker. Baksteemwerkers, pottenbakkers, granietwerkers en mijnwerkers lopen ook risico’s.
Overmatige blootstelling kan leiden tot chronische aandoeningen en auto-immuunziekten, waaronder sarcoïdose, sclerodermie, reumatoïde artritis en lupus erythematosus. Langdurige blootstelling aan siliciumoxide leidt ook tot schimmel- en bacteriële infecties en nierziektes.
Inademing verhoogt het risico op emfyseem, longziektes en bronchitis. Deze effecten komen vaker voor bij tabaksgebruikers en rokers.
Er zijn ook huidontstekingen gemeld, met inbegrip van bijwerkingen zoals jeuk, schilfering en roodheid. In het algemeen komen bijwerkingen niet voor wanneer de blootstelling binnen de normale grenzen wordt gehouden.
Laatste update: 2021-05-30