Zuurstof
Inhoudsopgave
Wat is zuurstof?
Zuurstof (atoomnummer 8, symbool O) is een van de meest voorkomende elementen. Lucht bestaat voor 21% uit zuurstof en 78% stikstof. Het grootste deel van de korst van de Aarde bestaat uit silicium-zuurstof mineralen. Zuurstof is in vaste en vloeibare vorm paramagnetisch. Het is een kleurloos gas met een lichtblauwe kleur en het is oplosbaar in water.
Zuurstof is een gas ene een niet-metaal. Niet-metalen komen in bij kamertemperatuur in twee toestanden voor: als vaste stof zoals selenium en fosfor en als gas (bijvoorbeeld zuurstof en stikstof). Zuurstof heeft twee allotropen, ozon en een diatomische vorm. Ozon heeft 3 zuurstofatomen terwijl de diatomaire vorm 2 ongepaarde elektronen heeft. Zuurstof heeft 3 oxidatietoestanden: +2, -2 en -1.
Chemische gegevens
| Symbool | O |
| Volledige naam | Zuurstof – oxygenium |
| Atoomnummer | 8 |
| Atoommassa (u) | 15,999 |
| Groep | Niet-metalen |
| Elektronegativiteit (Pauling) | 3,5 |
| Dichtheid (g.cm-3 bij 20 °C) | 1,429 |
| Smeltpunt (°C) | -219 |
| Kookpunt (°C) | -183 |
| Vanderwaalsstraal (nm) | 0,074 |
| Ionstraal (nm) | 0,14 |
| Isotopen | 2 |
| Elektronenconfiguratie | [He]2s2 2p4 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1314 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 3388 |
| Derder ionisatiepotentiaal (kJ.mol-1 ) | 5300 |
| Ontdekt door | Karl Wilhelm Scheele in 1771, Joseph Priestly in 1774 |
Bohr-Rutherford diagram
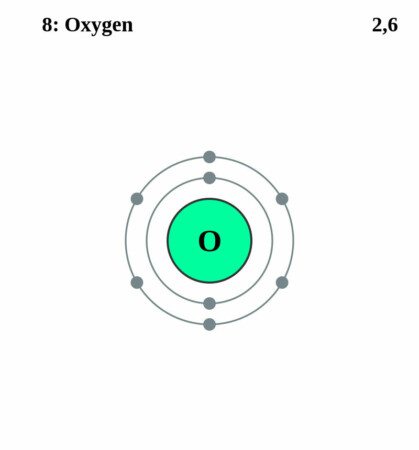
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa | Abundantie (%) |
|---|---|---|---|
| Zuurstof | 16 O | 15,994915 | 99,757 |
| 17 O | 16,999132 | 0,038 | |
| 18 O | 17,999160 | 0,205 |
Radioactieve isotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 12 O | 12,034405 | > 3,6 * 10-21 s |
| 13 O | 13,024812 | 8,58 ms |
| 14 O | 14,008596 | 70,620 s |
| 15 O | 15,003066 | 122,24 s |
| 19 O | 19,003580 | 26,740 s |
| 20 O | 20,004077 | 13,51 s |
| 21 O | 21,008656 | 3,42 s |
| 22 O | 22,009967 | 2,25 s |
| 23 O | 23,015688 | 98 ms |
| 24 O | 24,020473 | 77,4 ms |
| 25 O | 25,02946 | 5,18 * 10-21 s |
| 26 O | 26,03834 | 4,2 pico seconde |
Spectra
Absorptiespectrum
Emissiespectrum
Waar wordt zuurstof voor gebruikt?
Zuurstof heeft veel commerciële en wetenschappelijke toepassingen. Het wordt gebruikt om koolstof en zwavel te verwijderen uit ijzererts. In de chemische industrie wordt het gebruikt om heel veel verschillende producten te fabriceren waaronder bijvoorbeeld verschillende soorten polymeren maar ook antivries. De belangrijkste toepassingen van zuurstof zijn in de bereiding van chemische producten, glas en steenproducten.
Zuurstof wordt ook gebruikt als raketbrandstof en ondersteuning van leven. Onderzeeërs en duikers gebruiken een mengsel van lucht en zuurstof. Pure zuurstof wordt gebruikt in ziekenhuizen en in noodsituaties. Zuurstof is een sterk reactief element dat met vele andere chemische stoffen reageert. Alleen edelgassen reageren niet met zuurstof. We vinden zuurstof in veel organische verbindingen, in mineralen en gesteente en in water.
Zuurstof reageert met metalen en niet-metalen tot oxides. Zuurstof reageert ook tot zoutachtige componenten en basiscomponenten zoals silicaten. Dit zijn vaste verbindingen en vanwege de hoge kosten ze worden niet gebruikt om zuurstof te scheiden. De productiemethode van zuurstof is afhankelijk van de hoeveelheden die nodig zijn. Thermische decompositie is een van die methoden. Een andere methode om zuurstof te produceren is de decompositie van kaliumnitraat of kaliumchloraat. Bij de decompositie van kaliumchloraat wordt mangaanoxide als katalysator gebruikt. Ook kan zuurstof geproduceerd worden door de elektrolyse van water of door de decompositie van waterstofperoxide en oxides van zware metalen.
Algemeen voorkomende zuurstofverbindingen zijn bijvoorbeeld silicaten, water en verschillende ijzeroxides. Andere verbindingen zijn bijvoorbeeld bauxiet (aluminiumoxide), gypsum (calciumsulfaat), marmer en calciumcarbonaat. Organische verbindingen die zuurstof bevatten zijn o.a. ketonen, ethers en alcoholen. Ketonen worden gesynthetiseerd door ozonolyse, hydratatie van alkynen, hydrolyse van zouten. Ze hebben verschillende industriële toepassingen en worden gebruikt als farmaceutische producten en oplosmiddelen.
Ethers bevatten ook zuurstof en worden gesynthetiseerd door middel van synthese, hydratatie, Ullmann-condensatie en andere methoden. Andere verbindingen die zuurstof bevatten zijn onder andere amiden, zure anhydriden en carbonzuren. Daarnaast bevatten een aantal organische oplosmiddelen, waaronder furaan, mierenzuur en methanol, ook zuurstof. Met uitzondering van o.a. carotenen en squaleen bevatten de meeste biomoleculen zuurstof. Alle eiwitmoleculen bevatten zuurstof maar carbohydraten bevatten, in massa, het grootste percentage zuurstof. Het element komt in de vorm van hydroxylapatiet en calciumfosfaat ook voor in botten. Zuurstof vinden we verder ook in pyrimidines (heterocyclische verbindingen) van DNA en RNA.