Zwavel
Inhoudsopgave
Wat is zwavel?
Zwavel heeft atoomnummer 16 en symbool S. Het behoort tot de niet-metalen. Zwavel is geurloos en smaakloos. Het element is al sinds de oudheid bekend en het werd in China, Egypte en Griekenland gebruikt.
Chemische gegevens
| Symbool | S |
| Volledige naam | Zwavel |
| Atoomnummer | 16 |
| Atoommassa (g.mol-1 ) | 32,064 |
| Groep | Niet-metalen |
| Elektronegativiteit (Pauling) | 2,5 |
| Dichtheid (g.cm-3 bij 20 °C) | 2,07 |
| Smeltpunt (°C) | 113 |
| Kookpunt (°C) | 445 |
| Vanderwaalstraal (nm) | 0,127 |
| Ionstraal (nm) | 0,184 (-2); 0,029 (+6) |
| Isotopen | 4 |
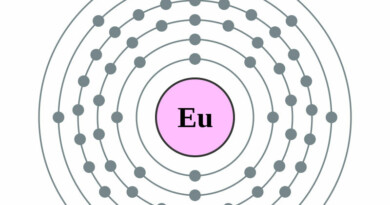
| Elektronenconfiguratie | [Ne]3s2 3p4 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 999,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 2251,78 |
| Derder ionisatiepotentiaal (kJ.mol-1 ) | 3356,75 |
| Standaard potentiaal (V) | -0,51 |
| Ontdekt door | bekend sinds de Oudheid |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 16 | Zwavel | 32 S | 31,972071 | 94,93 |
| 33 S | 32,971458 | 0,76 | ||
| 34 S | 33,967867 | 4,29 | ||
| 36 S | 35,967081 | 0,02 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 26 S | 26,02788 | 10 ms |
| 27 S | 27,01883 | 15,5 ms |
| 28 S | 28,00437 | 125 ms |
| 29 S | 28,99661 | 187 ms |
| 30 S | 29,984903 | 1,178 s |
| 31 S | 30,9795547 | 2,572 s |
| 35 S | 34,96903216 | 87,51 d |
| 37 S | 36,97112557 | 5,05 min |
| 38 S | 37,971163 | 170,3 min |
| 39 S | 38,97513 | 11,5 s |
| 40 S | 39,97545 | 8,8 s |
| 41 S | 40,97958 | 1,99 s |
| 42 S | 41,98102 | 1,013 s |
| 43 S | 42,98715 | 260 ms |
| 44 S | 43,99021 | 100 ms |
| 45 S | 44,99651 | 68 ms |
| 46 S | 46,00075 | 50 ms |
| 47 S | 47,00859 | 20 ms |
| 48 S | 48,01417 | 10 ms |
| 49 S | 49,02362 | <; 200 ns |
Bohr-Rutherford diagram
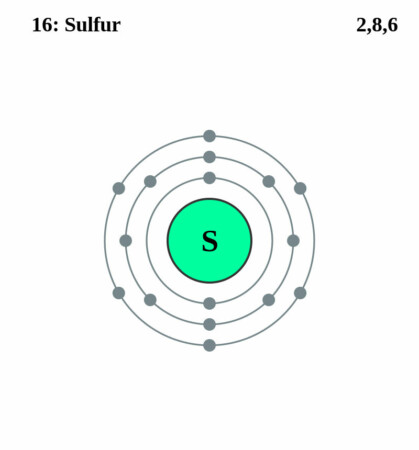
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Spectra
Absorptiespectrum
Emissiespectrum
Eigenschappen, isotopen, voorkomen en verbindingen
Zwavel reageert als oxidator met niet-metalen en metalen en als een reductor met fluor, zuurstof en andere elementen. Het kan verschillende verbindingen vormen waaronder ook organische, metaalsulfides, halides, oxides en anderen. Zwavel kan in feite met de meeste elementen uit het periodiek systeem reageren.
Zwavel heeft een kookpunt van 445 °C en een smeltpunt van 113 °C. Het element heeft 23 isotopen en 30 allotropen. Vier isotopen zijn stabiel. Dit zijn 36S, 34S, 33S en 32S.
Zwavelafzettingen komen onder andere voor in Indonesië, Chili, Japan en Polen. In het begin van deze eeuw waren China, Canada, Duitsland en Japan de grootste producenten van zwavel. Zwavel wordt veel gevonden in vulkanisch actieve gebieden en in de buurt van heetwaterbronnen. Zwavel komt voor in verschillende sulfides zoals rosalgar, galena, calcopyriet en pyriet.
Vulkanische gassen en zwavelhoudende waters bevatten verbindingen als waterstofsulfide (H2S) en zwaveldioxide (SO2). Zwavel en zijn verbindingen komen ook voor in aardgas, aardolie, steenkool maar ook in de vorm van bariumsulfaat en calciumsulfaat. Zoutkoepels in de Golf van Mexico en de moerassen in Louisiana in de Verenigde Staten bevatte ook zwavel.
Een van de processen om zwavel te extraheren is het Frasch-proces. Hierbij wordt water verhit tot stoom zodat afzettingen smelten en er water gemengd met zwavel geëxtraheerd kan worden. Zwavel wordt ook gewonnen als bijproduct bij de oliewinning en raffinage. Ook bij de verwerking van nikkel-, cadmium-, koper-, zink- en loodertsen komt zwavel vrij. Zwaveltrioxide (SO3) wordt omgezet naar zwavelzuur (H2SO4) en dat is weer verkrijgbaar in verschillende concentraties.
Commerciële toepassingen
Zwavel wordt in veel toepassingen gebruikt. We vinden het o.a. terug in meststoffen, insecticiden, antischimmelmiddelen en lucifers. Het wordt ook gebruikt in vuurwerk, munitie en wasmiddelen. Zwavel wordt gebruikt in de farmaceutische en chemische industrie om er oplosmiddelen, fijnchemicaliën en beton mee te produceren.
Zwavelzuur is een zuur dat vele toepassingen kent. Het wordt gebruikt als elektroliet, schoonmaakmiddel en katalysator. Het wordt ook toegevoegd aan ontstoppers die papier, haren, vet en vuil moeten verwijderen. Ook wordt zwavelzuur toegevoegd aan geneesmiddelen voor mondzweren.
Zwavel wordt gebruikt bij de productie van explosieven, bladmetaal, petroleumproducten en vezels. Ook wordt het toegepast bij de productie van papier, wasmiddelen en pigmenten. Zwavelverbindingen worden toegevoegd aan smeermiddelen en gebruikt bij de productie van esters, anorganische zouten, medicijnen en kleurstoffen.
Sommige zwavelverbindingen worden gebruikt bij de productie van oplosmiddelen, rubbers, en kunstzijde.
Gevaren, aminozuren & effecten voor de omgeving
Essentiele aminozuren zoals cysteïne en methionine bevatten zwavel. Amizonuren als taurine en cysteïne zijn componenten van co-enzymen, enzymen en hormonen. Taurine is belangrijk voor een goed functioneren van ons centrale zenuwstelsel, de skeletspieren en het cardiovasculaire systeem. Cysteïne is een ander aminozuur dat zwavel bevat. Het komt voor in eiwitten maar ook in planten en dierlijk voedsel.
Ook voedsel zoals eieren, vlees, vis, gevogelte, noten en peulvruchten bevatten zwavel. Groenten als spuitjes, kool, broccoli, rapen en boerenkool, zijn goede bronnen van zwavel.
Zwavelverbindingen kunnen echter giftig zijn. Ze kunnen ademhalingsproblemen, longembolie, doofheid, lever- en nierbeschadigingen en spijsverteringsproblemen veroorzaken. Blootstelling leidt ook tot hartschade, slechte bloedcirculatie, gedragsveranderingen en verzwakte immuniteit.
Waterstofsulfide is een giftig gas dat ook als moerasgas bekend is. Het is kleurloos, zwaarder dan lucht en het wordt gebruikt als reductor en als bleekmiddel. Bij dieren kan blootstelling aan te veel waterstofsulfide leiden tot ernstige systeemschade zoals hersenschade en andere aandoeningen.