Fosfor
Inhoudsopgave
Wat is fosfor?
Fosfor is een element met atoomnummer 15 en symbool P. Het is een niet-metaal met een monoklinische structuur en 3 allotropen: rode, witte en zwarte fosfor. Fosfor kent 3 oxidatietoestanden: 5,4 en 3 en het is een multivalent niet-metaal. Het element komt voor in de vorm van fosfaten, als organofosfaten en in mineralen.
| Symbool | P |
| Volledige naam | Fosfor |
| Atoomnummer | 15 |
| Atoommassa (g.mol-1 ) | 30,9738 |
| Groep | Niet-metalen |
| Elektronegativiteit (Pauling) | 2,1 |
| Dichtheid (g.cm-3 bij 20 °C) | 1,83 |
| Smeltpunt (°C) | 44 (witte fosfor) |
| Kookpunt (°C) | 280 (witte fosfor) |
| Vanderwaalstraal (nm) | 0,128 |
| Ionstraal (nm) | 0,044 (+3); 0,038 (+5) |
| Isotopen | 1 |
| Elektronenconfiguratie | [Ne]3s23p3 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1012 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1903 |
| Tweede ionisatiepotentiaal (kJ.mol-1) | 2910 |
| Ontdekt door | Hennig Brandt in 1669 |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 15 | Fosfor | 31 P | 30,973762 | 100 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
| 24 P | 24,03435 | onbekend |
| 25 P | 25,02026 | < 30 ns |
| 26P | 26.01178 | 43,7 ms |
| 27P | 25,02026 | < 30 ns |
| 28P | 26,999230 | 270,3 ms |
| 29 P | 28,9818006 | 4,142 s |
| 30 P | 29,9783138 | 2,498 min |
| 32 P | 31,97390727 | 14,263 dagen |
| 33 P | 32,9717255 | 25,34 dagen |
| 34 P | 33,973636 | 12,43 s |
| 35 P | 34,9733141 | 47,3 s |
| 36 P | 35,978260 | 5,6 s |
| 37 P | 36,97961 | 2,31 s |
| 38P | 7,98416 | 0,64 s |
| 39P | 38,98618 | 190 ms |
| 40P | 39,99130 | 153 ms |
| 41P | 40,99434 | 100 ms |
| 42P | 42,00101 | 48,5 ms |
| 43P | 43,00619 | 36,5 ms |
| 44P | 44,01299 | 18,5 ms |
| 45P | 45,01922 | 8 ms |
| 46P | 46,02738 | 4 ms |
Omdat witte fosfor heel erg reactief is moet het onder water worden bewaard. Dit betekent ook dat het element niet vrij in de natuur voorkomt. Het is reactief, zacht, giftig en explosief. Zwarte fosfor kent een paar commerciële toepassingen en het wordt onder andere gebruikt voor het maken van anodes voor lithium-ion batterijen. Het is niet gemakkelijk te ontsteken en het is minder reactief dan witte en rode fosfor. Het is een goede geleider voor elektriciteit en, zoals de naam al aangeeft, heeft het een zwarte kleur. Rode fosfor ontstaat als witte fosfor aan licht wordt blootgesteld of als witte fosfor wordt verhit waardoor het amorf wordt. Het allotroop heeft een polymeerstructuur en het wordt gebruikt bij de productie van lucifers.
Bohr-Rutherford diagram
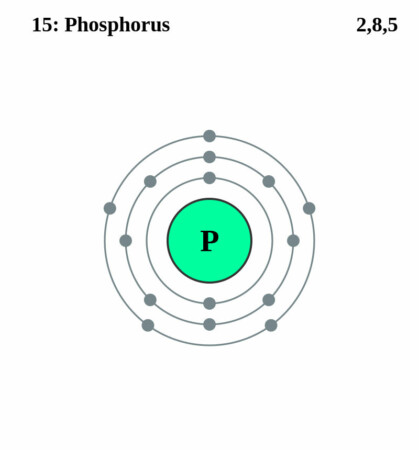
By Pumbaa (original work by Greg Robson) – Application: (generated by script), CC BY-SA 2.0 uk,
Spectra
Absorptiespectrum
Emissiespectrum
Ontdekking
Fosfor werd in 1669 ontdekt door de Duitse alchemist en natuurkundige Hennig Brand. Hij verwerkte, filtreerde en kookte een enorme hoeveelheid urine om het element te isoleren. Omdat fosfor als zenuwgas, gif en in explosieven werd gebruikt, werd het ook het element van de duivel genoemd.
Toepassingen
Er zijn verschillende commerciële toepassingen van fosfor. Het wordt onder andere toegepast in rookbommen en in sporenammunitie. Een van de verbindingen, fosforzuur, wordt gebruikt om er verschillende fosfaatverbindingen mee te maken. Fosforzuur wordt bovendien verwerkt in frisdranken. Tri-natriumfosfaat wordt gebruikt in waterontharders en schoonmaakmiddelen. Calciumfosfaat wordt toegepast in bakpoeder en in porselein. Sommige fosforverbindingen absorberen straling en kunnen licht uitzenden. Ze worden toegepast in televisies en lampen.
Menselijk lichaam
Anorganisch fosfor speelt een rol in de RNA- en DNA-cyclus. Cellen gebruiken fosfaat om adenosine trifosfaat (ATP) te transporteren. ATP is een vorm van energie voor cellen en alle processen die zich op celniveau afspelen hebben ATP nodig. In het menselijke bloed komt een kleine hoeveelheid fosfaat voor. Fosfor komt ook voor in tanden, buiten, weefsels en extracellulaire vloeistoffen.
De belangrijkste bronnen van fosfor is voedsel dat eiwitten bevat zoals vlees, melkproducten en brood. O.a. Jacobsschelpen, krab, meerval en lamsvlees bevatten veel fosfor. Ook verschillende soorten kazen bevatten grotere hoeveelheden fosfor. De hoeveelheden fosfor variëren per voedselsoort. In plantaardige olie bevindt zich weinig fosfor terwijl lever weer veel meer fosfor bevat.
Winning
Apatiet, waaronder ook hydroxylapatiet en fluorapatiet, behoort tot een groep fosfaathoudende mineralen. De grootste mijngebieden bevinden zich in Tunesië, de Verenigde Staten, Marokko en Rusland. Uitputting van fosforafzettingen is een bron van zorg omdat onze voedselproductie, in de vorm van meststoffen, er van afhankelijk is.
Gezondheid & gevaren
De inname van grote hoeveelheden fosfaat kan leiden tot gezondheidsproblemen zoals osteoporose en nierbeschadigingen. Witte fosfor is een zeer giftig allotroop en blootstelling eraan kan fatale gevolgen hebben. Inname kan leiden tot maagkrampen, misselijkheid en slaperigheid. Te grote hoeveelheden fosfor kunnen leiden tot nier-, hart- en leverschade.
Het element stapelt zich niet op in waterplanten en ander leven in water. Het reageert namelijk niet snel met andere elementen. Het blijft enkele dagen in de bodem en wordt daarna omgezet tot andere componenten. Op de bodem van meren en rivieren en diep in de grond kan het element honderdduizenden jaren blijven zonder dat het wordt omgezet.