Wolfraam
Inhoudsopgave
Wolfraam is een van de moeilijkste elementen in de natuur. Het heeft een hoge dichtheid en het is bijna onmogelijk te smelten. Zuiver wolfraam is een zilverwit metaal en als het tot een fijn poeder wordt verwerkt kan het zelfs spontaan ontbranden. Natuurlijk wolfraam bevat vijf isotopen. Daarnaast zijn er een groot aantal radioactieve isotopen bekend.
Wolfraam wordt op veel verschillende manieren gebruikt. Het is namelijk erg sterk en duurzaam. Het is zeer corrosiebestendig en het heeft het hoogste smeltpunt en de hoogste treksterkte van alle bekende elementen. Zijn kracht komt echter tot uiting als het wordt verwerkt in verbindingen. Zuiver wolfraam zelf is erg zacht.
Chemische gegevens
| Symbool | W |
| Volledige naam | Wolfraam |
| Atoomnummer | 74 |
| Atoommassa (g.mol-1 ) | 183,84 |
| Groep | transitiemetaal |
| Elektronegativiteit (Pauling) | 2,36 |
| Dichtheid (g.cm-3 bij 20 °C) | 19,30 |
| Smeltpunt (°C) | 3422 |
| Kookpunt (°C) | 5930 |
| Vanderwaalsstraal (nm) | 0,137 |
| Ionstraal (nm) | 0,068 (+4); 0,067 (+6) |
| Isotopen | 5 natuurlijke |
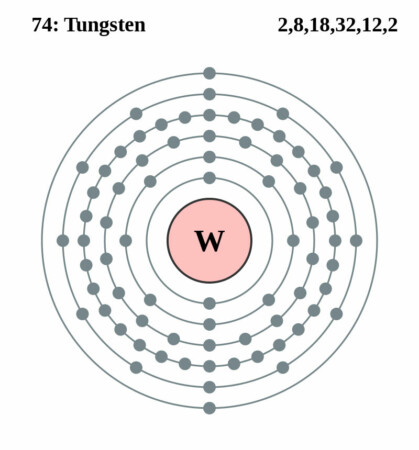
| Elektronenschil | [Xe]4f145d46s2 |
| Elektronen per schil | 2, 8, 18, 32, 12, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 770 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1700 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | -0,05 (W4+/W) |
| Ontdekt door: | 1783 door Fausto en Juan Jose de Elhuyar |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 74 | Wolfraam | 180 W | 179,946706 | 0,12 |
| 182 W | 181,948206 | 26,50 | ||
| 183 W | 182,950224 | 14,31 | ||
| 184 W | 183,950933 | 30,64 | ||
| 186 W | 185,954362 | 28,43 |
Radioisotopen
|
Nuclide |
Isotopische massa (u) |
Halveringstijd |
|---|---|---|
|
158W |
157,97456 |
1,37 ms |
|
159W |
158,97292 |
8,2 ms |
|
160W |
159,96848 |
90 ms |
|
161W |
160,96736 |
409 ms |
|
162W |
161,96349 |
1,36 s |
|
163W |
162,96252 |
2,8 s |
|
164W |
163,95895 |
6,3 s |
|
165W |
164,95828 |
5,1 s |
|
166W |
165,95502 |
19,2 s |
|
167W |
166,95481 |
19,9 s |
|
168W |
167,95180 |
51 s |
|
169W |
168,95177 |
76 s |
|
170W |
169,94922 |
2,42 min |
|
171W |
170,94945 |
2,38 min |
|
172W |
171,94729 |
6,6 min |
|
173W |
172,94769 |
7,6 min |
|
174W |
173,94608 |
33,2 min |
|
175W |
174,94672 |
35,2 min |
|
176W |
175,94563 |
2,5 uur |
|
177W |
176,94664 |
132 min |
|
178W |
177,94587 |
21,6 dagen |
|
179W |
178,94707 |
37,05 min |
|
180W |
179,94670 |
1,8 * 1018 jaar |
|
181W |
180,94819 |
121,2 dagen |
|
185W |
184,95341 |
75,1 dagen |
|
187W |
186,95716 |
23,72 uur |
|
188W |
187,95848 |
69,78 dagen |
|
189W |
188,96191 |
11,6 min |
|
190W |
189,96318 |
30,0 min |
|
191W |
190,96660 |
20 s |
|
192W |
191,96817 |
10 s |
Geschiedenis
De eerste toepassingen van wolfraam dateren van meer dan 350 jaar geleden. Chinese porseleinmakers gebruikten wolfraampigment dat een unieke perzikkleur heeft.
Veel later, in 1779, onderzocht Peter Woulfe een mineraal uit Zweden en hij realiseerde zich dat het een nieuw soort metaal bevatte. In 1781 zette Wilhelm Scheele het onderzoek naar dit nieuwe metaal voort en hij isoleerde een zuur wit oxide. Geen van deze twee mannen kreeg echter de eer van de ontdekking.
Die ging naar Juan en Faustode Elhuyar. Deze twee Spaanse chemici isoleerden in 1783 het metaaloxide uit wolframiet. Ze reduceerden het vervolgens tot wolfraammetaal door het te verhitten met koolstof.
Bronnen
Het meeste wolfraam wordt gewonnen in China, Zuid Korea, Bolivia, Groot Brittannië, Rusland en Portugal. Het komt op veel plekken voor maar ongeveer 80% van de wereldvoorraad wordt gecontroleerd door China.
Het element komt van nature voor in de mineralen scheeliet, wolframiet, huebneriet en ferberiet. Het wordt uit mineralen gewonnen door wolfraamoxide met waterstof of koolstof te reduceren.
Als metaal wordt wolfraam vaak in legeringen gebruikt. De hardste legeringen worden met behulp van diamanten vormgegeven. Alleen diamant is harder dan sommige wolfraamlegeringen.
Toepassingen
Een van de meest algemene en sterkste wolfraamverbindingen is wolfraamcarbide. Vanwege zijn sterkte worden wolfraamverbindingen gebruikt om zaagbladen en boren te verharden. Het kan wel 10 minuten duren om met behulp van een diamantsnijsysteem één boor uit wolfraam te snijden. Sommige juweliers gebruiken wolfraamcarbide om trouwringen en andere ringen te maken.
Een andere bijzonder nuttige wolfraamverbinding is wolfraamsulfide. Het wordt als droog smeermiddel gebruikt bij temperaturen tot wel 500 °Celsius.
Enkele andere toepassingen van wolfraam zijn onder meer bij het verdampen van metaal, het vervaardigen van verf, het maken van glas-op-metaal afdichtingen en het maken en elektronen- en televisiebuizen.
Het leger gebruikt wolfraam om kogels en raketten te maken die worden gebruikt bij “kinetische bombardementen”. Dit type aanvalswapen gebruikt een super dicht materiaal om door een pantser te breken in plaats van explosieven.
Zijn hittebestendigheid is nuttig bij het gebruik in verwarmingselementen voor elektrische ovens, ruimtevaarttoepassingen, lassen en andere toepassingen bij hoge temperaturen. Om deze reden werd wolfraam ook gebruikt bij het maken van verschillende soorten verlichting. Hoe heter het filament kan worden zonder te smelten hoe helderder de lamp. In 1908 ontdekte de uitvinder William Coolidge dat wolfraam een ideaal filamentmateriaal was. Tegenwoordig gebruiken de meeste lampen echter energiezuinigere materialen. Het wordt echter nog steeds gebruikt in röntgenfilamenten en in elektrische contacten van verschillende elektronicatoepassingen.
Er zijn sommige bacteriën die wolfraam gebruiken om carbonzuren te reduceren naar aldehyden.
Weetjes
Wolfraam kan gebruikt worden voor bedrog. Het element heeft dan wel niet de glans van goud maar wel nagenoeg dezelfde dichtheid (> 0,36% verschil) en dat betekent dat als je een reep wolfraam bedekt met een dun laagje goud en je test die reep om te zien of hij evenveel weegt als goud dan zal het verschil minimaal zijn. Zo heeft men wolfram aangetroffen in nagemaakte gouden repen.
In Angelsaksische landen wordt wolfraam tungsten genoemd maar de Zweedse term “tung sten”, die “zware steen” betekent.
De naam wolfraam komt van het mineraal waar het element in is ontdekt, wolframiet. Wolframiet betekent “de verslinder van tin”. Dat is een toepasselijke naam want het mineraal verstoort het smelten van tin.