Tantalum
Inhoudsopgave
Herkomst woord
Tantaal is vernoemd naar de Griekse mythologische figuur Tantalos.
Chemische gegevens
| Symbool | Ta |
| Volledige naam | Tantaal |
| Atoomnummer | 73 |
| Atoommassa (g.mol-1 ) | 180,94788 |
| Groep | transitie metaal |
| Elektronegativiteit (Pauling) | 1,5 |
| Dichtheid (g.cm-3 bij 20 °C) | 16,69 |
| Smeltpunt (°C) | 3017 |
| Kookpunt (°C) | 5458 |
| Vanderwaalsstraal (nm) | 0,1425 |
| Ionstraal (nm) | 0,070 (+5) |
| Isotopen | 2 natuurlijke |
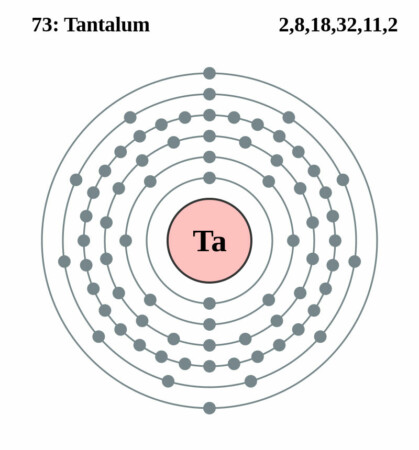
| Elektronenschil | [Xe]4f145d36s2 |
| Elektronen per schil | 2, 8, 18, 32, 11, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 761 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1500 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1802 door Anders Gustaf Ekeberg |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 73 | Tantalum | 180 Ta | 179,947466 | 0,012 |
| 181 Ta | 180,947996 | 99,988 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 156Ta | 155,97230 | 144 ms |
| 157Ta | 156,96819 | 10,1 ms |
| 158Ta | 157,96670 | 49 ms |
| 159Ta | 158,96301 | 1,04 s |
| 160Ta | 159,96149 | 1,70 s |
| 161Ta | 160,95842 | 3 s |
| 162Ta | 161,95729 | 3,57 s |
| 163Ta | 162,95433 | 10,6 s |
| 164Ta | 163,95353 | 14,2 s |
| 165Ta | 164,95077 | 31,0 s |
| 166Ta | 165,95051 | 34,4 s |
| 167Ta | 166,94809 | 1,33 min |
| 168Ta | 167,94805 | 2,0min |
| 169Ta | 168,94601 | 4,9 min |
| 17Ta | 169,94618 | 6,76 min |
| 171Ta | 170,94448 | 23,3 min |
| 172Ta | 171,94490 | 36,8 min |
| 173Ta | 172,94375 | 3,14 uur |
| 174Ta | 173,94445 | 1,14 uur |
| 175Ta | 174,94374 | 10,5 uur |
| 176Ta | 175,94486 | 8,09 uur |
| 177Ta | 176,94447 | 56,56 uur |
| 178Ta | 177,94577 | 9,31 min |
| 179Ta | 178,94592 | 1,82 jaar |
| 180Ta | 179,94746 | 8,152 uur |
| 182Ta | 181,95015 | 114,43 dagen |
| 183Ta | 182,95137 | 5,1 dagen |
| 184Ta | 183,95400 | 8,7 uur |
| 185Ta | 184,95555 | 49,4 min |
| 186Ta | 185,95855 | 10,5 min |
| 187Ta | 186,96053 | 2 min |
| 188Ta | 187,96370 | 20 s |
| 189Ta | 188,96583 | 3 s |
| 190Ta | 189,96923 | 0,3 s |
Bohr – Rutherford diagram
Ontdekking
Tantaal is in 1802 ontdekt door Anders Ekeberg. Hij dacht dat tantaal en niobium identieke elementen waren maar in 1844 toonden Rowe en in 1866 de Zwitserse chemicus Jean Galissard de Marignac aan dat het twee verschillende elementen zijn.
Eigenschappen van tantaal
Tantaal is een hard maar buigzaam metaal. In zijn pure vorm kan het tot een zeer fijne draad worden getrokken. Tantaal is bij temperaturen beneden 150 °C nagenoeg immuun voor chemische aanvallen. Tantaaloxidefilms zijn zeer stabiel en hebben zowel goede rectificerende als diëlectrische eigenschappen. Tantaal heeft een smeltpunt dat alleen wordt overschreden door twee andere elementen en het wordt bij hogere temperaturen veel reactiever.
Bronnen van tantaal
Tantaal komt van nature voor in het mineraal columbiet-tantaliet. Het wordt voornamelijk gevonden in Australië, Brazilië, Mozambique, Thailand, Portugal, Nigeria en Canada. Het scheiden van tantaal van niobium vereist ofwel elektrolyse, reductie van kaliumfluorotantalaat met natrium of het laten reageren van het carbide met oxide. Natuurlijk tantaal heeft twee isotopen.
Toepassingen van tantaal
Tantaal wordt gebruikt in verschillende legeringen om een hoge sterkte, buigzaamheid en een hoog smeltpunt toe te voegen. Wanneer het tot een fijne draad wordt getrokken wordt het gebruikt als een filament voor het verdampen van metalen zoals aluminium. Meer dan de helft van het gebruik van tantaal is voor elektrolytische condensatoren en onderdelen van vacuümovens. Het element wordt ook gebruikt om chemische procesapparatuur, kernreactoren, vliegtuigen en raketonderdelen te maken. Tantaal heeft zijn nut gevonden bij het maken van chirurgische apparaten omdat het volledig immuun is voor lichaamsvloeistoffen. Tantaaloxide wordt gebruikt om speciaal glas te maken met een hoge brekingsindex voor bijvoorbeeld cameralenzen.