Koolstof
Inhoudsopgave
Beschrijving
Koolstof (atoomnummer 6,symbool C) is een tetravalent en niet-metallisch element. Het behoort tot de weinige elementen die sinds de antieke oudheid bekend zijn. Koolstof heeft verschillende allotropen waaronder amorf koolstof, diamant en grafiet. Afhankelijk van het allotrope vorm kunnen de fysische eigenschappen van koolstof sterk variëren. Grafiet bijvoorbeeld is zwart en ondoorzichtig terwijl diamant erg transparant is. Grafiet is zo zacht dat je er mee op papier kan schrijven terwijl diamant een van de hardste materialen is die we kennen. Grafiet is een goede geleider terwijl een hele slechte elektrische geleider is. Maar tegelijkertijd heeft het onder normale omstandigheden een hogere thermische geleidbaarheid dan andere materialen.
Gegevens Koolstof
| Symbool | C |
| Volledige naam | Koolstof – Carbonium |
| Atoomnummer | 6 |
| Atoommassa (g.mol-1) | 12,011 |
| Groep | Niet-metalen |
| Elektronegativiteit (Pauling) | 2,5 |
| Dichtheid (g.cm-3 bij 20 °C) | 2,2 |
| Smeltpunt (°C) | 3652 |
| Kookpunt (°C) | 4827 |
| Vanderwaalsstraal (nm) | 0,091 |
| Ionstraal (nm) | 0,26 (-4); 0,015 (+4) |
| Isotopen | 3, waarvan 1 radioactief |
| Elektronenconfiguratie | [He]2s2 2p2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1086,1 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 2351,9 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 4618,8 |
| Ontdekt door | bekend sinds de oudheid |
Bohr-Rutherford diagram
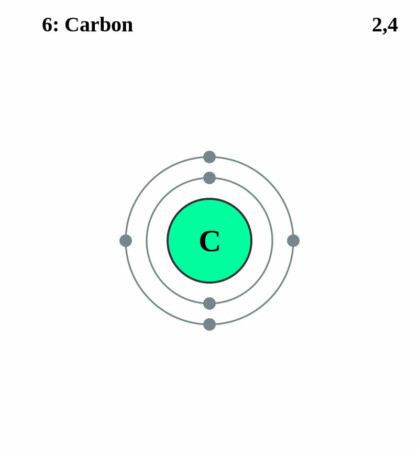
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Isotopen
| Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|
| Koolstof | 12 C | 12,000000 | 98,93 |
| 13 C | 13,003355 | 1,07 | |
| 14 C | 14,003242 | * |
Radioactieve isotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 8 C | 8,037675 | 3,5 * 10-21 s ns |
| 9 C | 9,031037 | 126,5 ms |
| 10 C | 10,016853 | 19,3009 s |
| 11 C | 11,011434 | 20,364 minuten |
| 14 C | 14,003242 | 5707,76 jaar |
| 15 C | 15,010599 | 2,449 s |
| 16 C | 16,014701 | 747 ms |
| 17 C | 17,022586 | 193 ms |
| 18 C | 18,026759 | 92 ms |
| 19 C | 19,034805 | 46,2 ms |
| 20 C | 20,040320 | 16 ms |
| 21 C | 21,04900 | <30 ns |
| 22 C | 22,05755 | 6,2 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Toepassingen
Grafiet wordt in de vorm van koolstof veel toegepast als een smeermiddel. Grafiet komt in de natuur voor maar wordt ook geproduceerd door petroleumcokes in een zuurstofvrije oven te behandelen. In de natuur wordt grafiet gevonden in een alpha en een beta vorm. Hun eigenschappen zijn identiek maar de alpha en de beta vorm hebben een verschillende kristalstructuur. Het grafiek dat commercieel wordt geproduceerd heeft een alpha vorm. Naast gebruik als smeermiddel wordt grafiet in de vorm van cokes gebruikt bij de productie van staal. Cokes wordt geproduceerd als zachte kool in een oven wordt verhit zonder dat daar zuurstof bij kan komen. Als grafiet in een potlood wordt gebruikt dan wordt het vaak “lood” genoemd maar in feite is het grafiet.
Amorf koolstof ontstaat door materiaal te verbranden dat koolstof bevat, zonder dat daar zuurstof bij komt zodat het volledig kan verbranden. Carbon black is zwarte roet. Het wordt gebruikt bij de productie van rubber, verven en inkten. Roet kan in verschillende vormen gemaakt worden. Zo kan het als de kern van droge accu’s gebruikt worden. Koolstof is een belangrijk element voor leven en alle levende organismes.
Zonder koolstof zou leven zoals we dat kunnen niet bestaan. Koolstof is commercieel ook belangrijk. Het wordt gebruikt als koolwaterstoffen, in het bijzonder dan als ruwe olie en aardgas. Uit ruwe olie wordt met behulp van destillatie o.a. kerosine en diesel geproduceerd. Ook cellulose bevat koolstof. Cellulose is een natuurlijk polymeer dat door planten wordt geproduceerd in de vorm van hennep, linnen en katoen. Sommige koolstofpolymeren zijn commercieel waardevol en hebben een dierlijke herkomst. Dit zijn polymeren als kasjmier, wol en zijde.
Plastics worden gemaakt van polymeren met een synthetische koolstof als herkomst. Aan de keten zijn vaak stikstof en zuurstof toegevoegd. Voor veel van die synthetische polymeren wordt ruwe olie als grondstof gebruikt. Het gebruik van koolstofverbindingen en van koolstof zelf is zeer gevarieerd.
Met ijzer worden er legeringen gemaakt waarvan koolstofstaal de meest voorkomende is. In combinatie met klei vormt grafiet het materiaal dat gebruikt wordt in potloden om te tekenen en te schrijven. Koolstof wordt ook gebruikt als gietmateriaal voor de vervaardiging van glas, het wordt als pigment gebruikt en bij het galvaniseren, In elektroden van droge batterijen en in borstels van elektromotoren wordt koolstof gebruikt. Ook in kerncentrales wordt koolstof als neutronenmoderator gebruikt. Houtskool wordt gebruikt om te barbecueën, om mee te tekenen, om ijzer te smelten en voor nog veel meer andere processen. Olie, steenkool en hout worden gebruikt om energie te produceren en ruimtes te verwarmen. Industriële diamanten worden gebruikt bij het polijsten, snijden en boren in steen en metalen. Diamanten van edelsteenkwaliteit worden gebruikt om er juwelen van te maken.