Dubnium
Inhoudsopgave
Herkomst woord
Dubnium is vernoemd naar Dubna. In deze plaats is het Russische Joint Institute for Nuclear Research gevestigd. Dit instituut heeft het element voor het eerst gerapporteerd. Sommige wetenschappers van de universiteit van Berkeley in Californië hebben geprobeerd om het element “Hahnium” te noemen. Dit naar de Duitse wetenschapper Otto Hahn. Ofschoon de International Union of Pure and Applied Chemistry (IUPAC) de naam Dubnium aanhoudt zijn er nog steeds wetenschappers die het element Hahnium noemen.
Chemische gegevens
| Symbool | Dubnium |
| Volledige naam | Db |
| Atoomnummer | 105 |
| Atoommassa (g.mol-1 ) | 268 |
| Groep | transitie metaal |
| Elektronegativiteit (Pauling) | — |
| Dichtheid (g.cm-3 bij 20 °C) | 29,3 (berekend) |
| Smeltpunt (°C) | — |
| Kookpunt (°C) | — |
| Vanderwaalsstraal (nm) | — |
| Ionstraal | — |
| Isotopen | — |
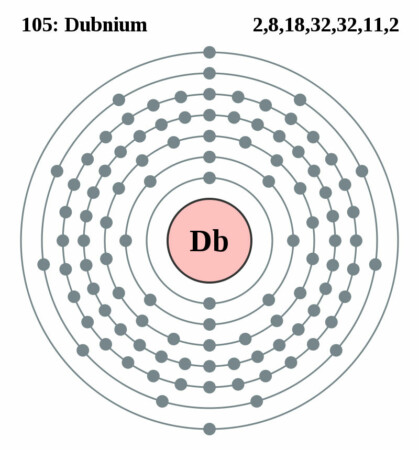
| Elektronenschil | [Rn]5f14 6d3 7s2 |
| Elektronen per schil | 2, 8, 18, 32, 32, 11, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 665 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1547 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2378 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1970, Joint Institute for Nuclear Research, Dubna, Rusland en Lawrence Berkeley Laboratory, Verenigde Staten |
Ontdekking
De ontdekking van element 105 werd in 1967 door wetenschappers in Dubna aangekondigd. Hun rapporten waren gebaseerd op het vinden van enkele Dubnium isotopen waarbij ze gebruikmaakten van tijdgebonden metingen van alpha energieën. In april 1970 bevestigden ze hun bevindingen door het element daadwerkelijk te synthetiseren.
In dezelfde periode rapporteerden wetenschappers van de universiteit van Berkeley dat ook zij het element hadden gemaakt. Er waren ook rapporten dat ze het element in 1969 hadden gemaakt en andere rapporten die zeiden dat ze de Russische methodes om het element te maken niet konden reproduceren met dezelfde resultaten. Wie het nu dus als eerste heeft gemaakt is nog steeds onduidelijk.
Eigenschappen van Dubnium
Dubnium is een synthetisch element waar weinig over bekend is. Men neemt aan dat het een vast metaal is.
Er zijn 7 isotopen bekend. Het meest stabiele isotoop is 268Db dat een halfwaardetijd heeft van ongeveer 32 uur. Het vervalt door middel van spontane splijting.
Voor in de natuur voorkomende elementen wordt de atoommassa berekend aan de hand van het gemiddelde atoommassa van de isotopen die in de natuur voorkomen van dat element. Voor door mensen gemaakte transuranium elementen is er echter geen natuurlijke abundantie. De IUPAC afspraak is om de atoommassa van het langstlevende isotoop te gebruiken. Deze atoommassa’s zijn dan wel onder voorbehoud want er kan altijd een nieuw isotoop gevonden worden dat een langere halfwaardetijd heeft.
Bohr-Rutherford diagram
CC BY-SA 2.0 uk, Link
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 256Db | 256,10813 | 1,9 s |
| 257Db | 257,10772 | 1,53 s |
| 258Db | 258,10923 | 4,5 s |
| 259Db | 259,10961 | 0,51 s |
| 260Db | 260,11130 | 1,52 s |
| 261Db | 261,11206 | 1,8 s |
| 262Db | 262,11408 | 35 s |
| 263Db | 263,11499 | 29 s |
| 266Db | 266,12103 | 20 min |
| 267Db | 267,12238 | 73 min |
| 268Db | 268,12545 | 32 uur |
| 270Db | 270,13071 | 23,15 uur |
Bronnen van Dubnium
Dubnium kan alleen kunstmatig worden gemaakt. Er zijn alleen zeer kleine hoeveelheden geproduceerd en dat kan alleen maar met behulp van een lineaire versneller.
Toepassingen van Dubnium
Er zijn slechts kleine hoeveelheden dubnium geproduceerd en de isotopen hebben allemaal erg korte halfwaardetijden. Het element is alleen interessant voor wetenschappelijk onderzoek.