Beryllium
Inhoudsopgave
Beschrijving
Beryllium (atoomnummer 4, symbool Be) is een tweewaardig element dat van nature in combinatie met verschillende mineralen en metalen voorkomt. Het wordt gevonden in de samenstelling van sommige edelstenen waaronder chrysoberyl en beryl. In vrije vorm is beryllium een lichtgewicht, sterk, bros en staalgrijs aardalkalimetaal.
Chemische gegevens
| Symbool | Be |
| Volledige naam | Beryllium |
| Atoomnummer | 4 |
| Atoommassa (g.mol-1) | 9,0122 |
| Groep | Aardalkalimetalen |
| Elektronegativiteit (Pauling) | 1,57 |
| Dichtheid (g.cm3 bij 20°C) | 1,86 |
| Smeltpunt (°C) | 1280 |
| Kookpunt (°C) | 1500 |
| Vanderwaalsstraal | — |
| Ionstraal | — |
| Isotopen | 1 |
| Elektronenschil | 1s2 s2 of [He]2s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 899,2 |
| Tweede ionisatiepotentiaal (kj.mol-1 ) | 1757 |
| Standaard potentiaal (V) | -1,70 |
| Ontdekt door | Vauquelin in 1789 |
Gezondheid en gevaar
Beryllium is een erg giftig metaal en blootstelling boven de grenswaarde kan leiden tot berylliosis of acute berylliumziekte. Blootstelling vindt meestal plaats door inademing. Er zijn verschillende effecten verbonden aan blootstelling aan beryllium. Gecombineerd met eiwit kan beryllium neerslaan in de nieren, milt en lever. In een combinatie met een biologisch eiwit kan er een chronische toestand ontstaan die geassocieerd is met een hypergevoelige reactie van het immuunsysteem. De toxische effecten van beryllium zijn voornamelijk gericht op het ademhalingssysteem, de longblaasjes en de longen in zijn algemeenheid.
Voordat de toxische effecten van beryllium werden ontdekt werd het metaal breed toegepast in veel industriële sectoren. Tegenwoordig worden er strenge veiligheidseisen gesteld aan het werken met beryllium. Dankzij die maatregelen is er relatief veilig met beryllium te werken en wordt het in veel producten toegepast.
Isotopen
| Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|
| Beryllium | 9 Be | 9,012182 | 100 |
Radioactieve isotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
|---|---|---|
| 5 Be | 5,04079 | onbekend |
| 6 Be | 6,019726 | 5 * 10-21 s |
| 7 Be | 7,016930 | 53,2176 dagen |
| 8 Be | 8,005305 | 8,1903 * 10-17 s |
| 10 Be | 10,013534 | 1,51 * 106 jaar |
| 11 Be | 11,021658 | 13,81 seconden |
| 12 Be | 12,026921 | 21,5 ms |
| 13 Be | 13,03569 | 1,0 * 10-21 s |
| 14 Be | 14,042893 | 4,35 ms |
| 15 Be | 15,05346 | 7,9 * 10-22 s |
| 16 Be | 16,06192 | 6,5 * 10-22 s |
Bohr-Rutherford diagram
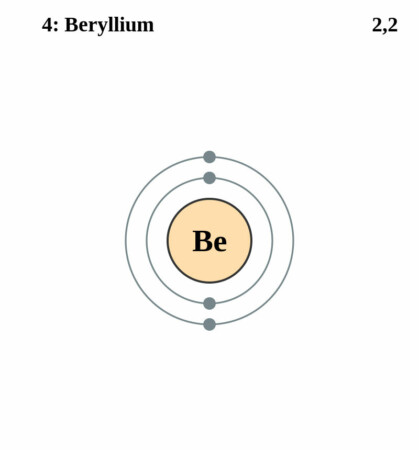
By Pumbaa (original work by Greg Robson) – CC BY-SA 2.0 uk,
Spectra
Absorptiespectrum
Emissiespectrum
Toepassingen
Beryllium wordt vaak gebruikt om legeringen harder te maken, in het bijzonder beryllium-koper. Oor zijn thermische stabiliteit, buigstijfheid, lage dichtheid en warmtegeleidende vermogen wordt beryllium gebruikt in structurele toepassingen en dan vooral in de lucht- en ruimtevaart. Het wordt gebruikt in ruimtevaartuigen, raketten, hogesnelheidsvliegtuigen en communicatiesatellieten. Vanwege zijn atoommassa en lage dichtheid is het metaal transparant voor ioniserende straling zoals röntgenstraling. Beryllium wordt ook veel gebruikt voor experimenten in de deeltjesfysica en in röntgenapparaten. Vanwege de hoge thermische geleidbaarheid worden berylliumoxide en beryllium gebruikt bij het thermisch verzinken en bij het transport van warmte. Beryllium wordt gebruikt om er spiegels van te maken, stralingsschermen, het wordt verwerkt in elektronica, magnetische toepassingen, nucleaire toepassingen, etc. het wordt ook gebruikt om er hoogfrequente speakerdrivers mee te maken. Berylliumoxide wordt toegepast daar waar een combinatie van twee eigenschappen nodig is: die van hittegeleider en die van elektrische isolator. Berylliumoxide wordt vaak toegepast als isolator bij de productie van radiofrequentiezenders.
Ontdekking
Beryllium is in 1798 ontdekt door de Franse Chemicus Louis Nicolas Vauquelin. Hij was met aluminium aan het werken toen hij een wit poeder zag dat geen aluminium of een aluminiumverbinding was. Hij noemde het gluinium want het smaakte zoet als glucose. Het duurde tot 1828 toen de Duitse metallurgist Wohler het element wist te reduceren tot zijn metaalvorm. Hij hernoemde het tot beryllium. Totdat Cooper de beryllium-aluminiumlegering patenteerde waren er geen commerciële toepassingen voor beryllium. Nadat het was gepatenteerd raakte koning Charles II geïnteresseerd in het metaal vanwege zijn eigenschappen. Vooral de lage dichtheid en de hoge stijfheid in relatie tot het gewicht maakt beryllium interessant. Daarnaast heeft beryllium een hoog smeltpunt, een lage thermische uitzettingscoëfficiënt en een goed elektrisch geleidend vermogen. Legeringen die beryllium bevatten zijn bestand tegen corrosie en de toevoeging van kleine hoeveelheden van het metaal aan legeringen zorgt ook voor een goede bescherming tegen metaalmoeheid.
Laatste update: 2021-05-30