Telluur
Inhoudsopgave
Herkomst naam
Tellurium is afkomstig van het Latijnse woord “Tellus” en dat betekent “aarde”. Tellurium wordt in het Nederlands ook wel Telluur genoemd.
Chemische gegevens
| Symbool | Te |
| Volledige naam | Tellurium |
| Atoomnummer | 52 |
| Atoommassa (g.mol-1 ) | 127,6 |
| Groep | Metalloïde |
| Elektronegativiteit (Pauling) | 2,1 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,24 |
| Smeltpunt (°C) | 449,5 |
| Kookpunt (°C) | 1810 |
| Vanderwaalsstraal (nm) | 0,137 |
| Ionstraal | 0,221 (-2); 0,089 (+4) |
| Isotopen | 7, waarvan 4 stabiel |
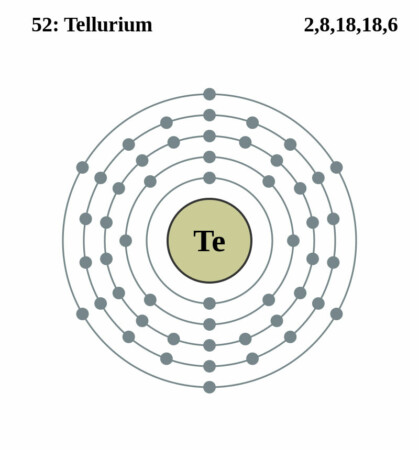
| Elektronenschil | [Kr]4d105s25p4 |
| Elektronen per schil | 2, 8, 18, 18, 6 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 869 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1790 |
| Derde ionisatiepotentiaal (kJ.mol-1) | 2698 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1782 Müller von Reichenstein |
Bohr-Rutherford diagram
Ontdekking
Telluur is in 1782 ontdekt door Muller von Reichenstein. Het was de Duitse chemicus Martin Klaproth die het element in 1798 zijn naam gaf.
Eigenschappen van Telluur
Tellurium is een zilverwit metalloïde. In zijn zuivere vorm heeft het een metalen glans. Kristallijn tellurium kan gemakkelijk worden verpulverd. In gesmolten toestand is tellurium corrosief voor koper, ijzer en roestvast staal.
Er zijn 30 isotopen bekend maar dan die 30 komen er 8 in de natuur voor. Het element en zijn verbindingen zijn giftig.
Bronnen van Telluur
Telluur wordt meestal gevonden in calaveriet, het telluride van goud (AuTe2), en gecombineerd met andere metalen.
Het wordt commercieel gewonnen bij het elektrolytisch raffineren van blisterkoper uit anodeslib. Het wordt af en toe in zijn oorspronkelijke staat gevonden. Amorf telluur wordt gemaakt door het neer te slaan uit een oplossing van telluurzuur (H6 TeO6).
Toepassingen van Telluur
Het element is een halfgeleider die in bepaalde richtingen of bij blootstelling aan licht een grotere elektrische geleidbaarheid vertoont.
Telluur wordt vaak gebruikt om de verwerkbaarheid van koper en roestvast staal te verbeteren. Het wordt gebruikt om straalkappen te maken, het wordt toegevoegd aan gietijzer en gebruikt in keramiek. Het toevoegen van telluur aan lood verbetert de sterkte en de hardheid van het metaal en vermindert de corrosie. Veel thermo-elektrische apparaten zijn gemaakt met bismuttelluride. Loodtelluride wordt toegepast in infrarooddetectoren.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 52 | Tellurium | 120 Te | 119,904020 | 0,09 |
| 122 Te | 121,903047 | 2,55 | ||
| 123 Te | 122,904273 | 0,89 | ||
| 124 Te | 123,902819 | 4,74 | ||
| 125 Te | 124,904425 | 7,07 | ||
| 126 Te | 125,903306 | 18,84 | ||
| 128 Te | 127,904461 | 31,74 | ||
| 130 Te | 129,906223 | 34,08 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 107Te | 106,93501 | 3,1 ms |
| 108Te | 107,92944 | 2,1 s |
| 109Te | 108,92742 | 4,6 s |
| 110Te | 109,92241 | 18,6 s |
| 111Te | 110,92111 | 19,3 s |
| 112Te | 111,91701 | 2,0 min |
| 113Te | 112,91589 | 1,7 min |
| 114Te | 113,91209 | 15,2 min |
| 115Te | 114,91190 | 5,8 min |
| 116Te | 115,90846 | 2,49 uur |
| 117Te | 116,90864 | 62 min |
| 118Te | 117,90582 | 6,00 d |
| 119Te | 118,90640 | 16,05 uur |
| 121Te | 120,90493 | 19,16 dagen |
| 127Te | 126,90522 | 9,35 uur |
| 128Te | 127,90446 | 2,2 * 1024 jaar |
| 129Te | 128,90659 | 69,6 min |
| 130Te | 129,90622 | 790 * 1018 jaar |
| 131Te | 130,90852 | 25,0 min |
| 132Te | 131,90855 | 3,204 dagen |
| 133Te | 132,91095 | 12,5 min |
| 134Te | 133,91136 | 41,8 min |
| 135Te | 134,91645 | 19,0 s |
| 136Te | 135,92010 | 17,63 s |
| 137Te | 136,92532 | 2,49 s |
| 138Te | 137,92922 | 1,4 s |
| 139Te | 138,93473 | 500 ms |
| 140Te | 139,93885 | 300 ms |
| 141Te | 140,94465 | 100 ms |
| 142Te | 141,94908 | 50 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30