Antimoon
Inhoudsopgave
Herkomst woord
Antimoon is vernoemd naar de Griekse woorden anti en monos en het betekent “een metaal dat niet alleen wordt gevonden”. Het chemische symbool Sb is afkomstig van de historische naam van het element, stibium.
Chemische gegevens
| Symbool | Sb |
| Volledige naam | Antimoon |
| Atoomnummer | 51 |
| Atoommassa (g.mol-1 ) | 121,76 |
| Groep | Metalloïden |
| Elektronegativiteit (Pauling) | 2,05 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,697 |
| Smeltpunt (°C) | 631 |
| Kookpunt (°C) | 1587 |
| Vanderwaalsstraal (nm) | 0,1159 |
| Ionstraal | 0,245 (-3), 0,062 (+5), 0,076 (+3) |
| Isotopen | 2 |
| Elektronenschil | [Kr]4d105s25p3 |
| Elektronen per schil | 2, 8, 18, 18, 5 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 834 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1595 |
| Derde ionisatiepotentiaal (kJ.mol-1) | 2443 |
| Standaard potentiaal (V) | 0,21 (Sb3+ /Sb) |
| Ontdekt door: | In de Oudheid |
Ontdekking
In de 17de eeuw was Antimoon al bekend en vermoedelijk werd het ook al eerder gebruikt.
Bohr-Rutherford diagram
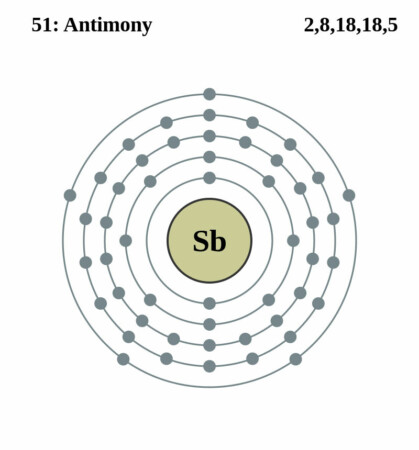
CC BY-SA 2.0 uk, Link
Eigenschappen van Antimoon
Antimoon is een zilverachtig, glanzend grijs metaal. Het maakt deel uit van de metalloïden. Antimoon is een slechte geleider van hitte en elektriciteit. Het metaal en zijn verbindingen kunnen giftig zijn.
Bronnen van antimoon
Antimoon is een zeldzaam element dat maar af en toe vrij in de natuur wordt gevonden. Het element komt meestal voor in de vorm van het mineraal sulfide stibniet (Sb2 S3).
Gebruik van antimoon
De zuivere vorm van antimoon wordt gebruikt om er bepaalde type van halfgeleiders zoals diodes en infrarood detectoren, mee te maken. Een legering van antimoon wordt gebruikt in batterijen, metalen met een lage wrijving, kleine wapens en kogels mee te maken. Ook wordt het gebruikt in kabelmantels en andere producten. Andere verbindingen van antimoon worden gebruikt om er verf, glas, aardewerk en keramiek mee te maken.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 51 | Antimoon | 121 Sb | 120,903818 | 57,21 |
| 123 Sb | 122,904216 | 42,79 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 103Sb | 102,93969 | 100 ms |
| 104Sb | 103,93647 | 0,47 s |
| 105Sb | 104,93149 | 1,12 s |
| 106Sb | 105,92879 | 0,6 s |
| 107Sb | 106,92415 | 4,0 s |
| 108Sb | 107,92216 | 7,4 s |
| 109Sb | 108,91813 | 17,3 s |
| 110Sb | 109,91675 | 23,0 s |
| 111Sb | 110,91316 | 75 s |
| 112Sb | 111,91239 | 51,4 s |
| 113Sb | 112,90937 | 6,67 min |
| 114Sb | 113,90927 | 3,49 min |
| 115Sb | 114,90659 | 32,1 min |
| 116Sb | 115,90679 | 15,8 min |
| 117Sb | 116,90483 | 2,80 uur |
| 118Sb | 117,90552 | 3,6 min |
| 119Sb | 118,90394 | 38,19 uur |
| 120Sb | 119,90507 | 15,89 min |
| 122Sb | 121,90517 | 2,7238 dagen |
| 124Sb | 123,90593 | 60,20 dagen |
| 125Sb | 124,90525 | 2,75856 jaar |
| 126Sb | 125,90725 | 12,35 dagen |
| 127Sb | 126,90692 | 3,85 dagen |
| 128Sb | 127,90916 | 9,01 uur |
| 129Sb | 128,90914 | 4,40 uur |
| 130Sb | 129,91165 | 39,5 min |
| 131Sb | 130,91198 | 23,03 min |
| 132Sb | 131,91446 | 2,79 min |
| 133Sb | 132,91525 | 2,5 min |
| 134Sb | 133,92038 | 0,78 s |
| 135Sb | 134,92517 | 1,68 s |
| 136Sb | 135,93035 | 0,923 s |
| 137Sb | 136,93531 | 450 ms |
| 138Sb | 137,94079 | 500 ms |
| 139Sb | 138,94598 | 300 ms |