Xenon
Inhoudsopgave
Xenon is een gas dat voornamelijk gebruikt wordt in verlichting. Het is een van de inerte oftewel edelgassen. Het is geurloos, kleurloos, smaakloos en chemisch niet-reactief. Het is niet giftig van zichzelf maar de verbindingen zijn sterke oxidatoren die wel erg giftig zijn.
Chemische gegevens
| Symbool | Xenon |
| Volledige naam | Xe |
| Atoomnummer | 54 |
| Atoommassa (g.mol-1 ) | 131,29 |
| Groep | edelgas |
| Elektronegativiteit (Pauling) | 2,6 |
| Dichtheid (g.cm-3 bij 20 °C) | 0,005887 |
| Smeltpunt (°C) | -111,75 |
| Kookpunt (°C) | -108,099 |
| Vanderwaalsstraal (nm) | — |
| Ionstraal (nm) | — |
| Isotopen | 9 stabiele isotopen |
| Elektronenschil | [Kr]4d105s25p6 |
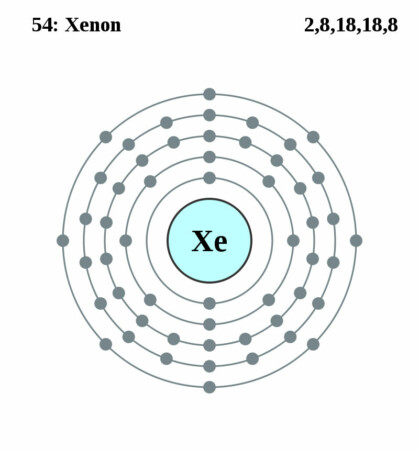
| Elektronen per schil | 2, 8, 18, 18, 8 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1170,4 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 2046,4 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3099,4 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1898, William Ramsey en Morris Travers |
Geschiedenis
Xenon werd in juli 1898 ontdekt door de Schotse chemicus William Ramsay en de Engelse chemicus Morris Travers. Het was niet hun eerste ontdekking. Het paar had ook al argon, neon en krypton geëxtraheerd uit vloeibare lucht.
De twee konden de ontdekking doen toen een rijke ondernemer, Ludwig Mond, hen een nieuwe machine schonk om vloeibare lucht te maken. Met deze nieuwe machine haalden ze meer krypton uit de lucht. Toen ze de krypton een aantal keren opnieuw hadden gedestilleerd isoleerden ze er een zwaarder gas uit. Ze onderzochten dit zwaardere gas in een vacuümbuis en ze zagen dat het een hele mooie blauw gloed uitstraalde. Ze plaatsten het nieuwe gas onder de edelgassen en noemden het Xenon, naar het Griekse woord “xenos”, dat vreemdeling betekent.
In 1962 toonde Neil Bartlett aan dat xenon eigenlijk niet inert is. Het kan reacties en verbindingen aangaan. Hij bewees dit door een fluorderivaat te maken. Sindsdien zijn er meer dan 100 xenonverbindingen gemaakt.
Natuurlijk Xenon heeft 9 stabiele isotopen en 20 instabiele isotopen. Sommige verbindingen die met xenon kunnen worden gemaakt zijn xenonbifluoride, xenondeuteraat, xenontrioxide, xenonhydraat, xenontetrafluoride en xenonhexafluoride. Een andere interessante verbinding is metallisch xenon dat gemaakt kan worden door het onder druk te zetten.
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 54 | Xenon | 124 Xe | 123,905896 | 0,09 |
| 126 Xe | 125,904269 | 0,09 | ||
| 128 Xe | 127,903530 | 1,92 | ||
| 129 Xe | 128,904779 | 26,44 | ||
| 130 Xe | 129,903508 | 4,08 | ||
| 131 Xe | 130,905082 | 21,18 | ||
| 132 Xe | 131,904154 | 26,89 | ||
| 134 Xe | 133,905395 | 10,44 | ||
| 136 Xe | 135,907220 | 8,87 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 110Xe | 109,94428 | 310 ms |
| 111Xe | 110,94160 | 740 ms |
| 112Xe | 111,93562 | 2,7 s |
| 113Xe | 112,93334 | 2,74 s |
| 114Xe | 113,92798 | 10,0 s |
| 115Xe | 114,92629 | 18 s |
| 116Xe | 115,92158 | 59 s |
| 117Xe | 116,92035 | 61 s |
| 118Xe | 117,91617 | 3,8 min |
| 119Xe | 118,91541 | 5,8 min |
| 120Xe | 119,91178 | 40 min |
| 121Xe | 120,91146 | 40,1 min |
| 122Xe | 121,90836 | 20,1 uur |
| 123Xe | 122,90848 | 2,08 uur |
| 125Xe | 124,90639 | 16,9 uur |
| 127Xe | 126,90518 | 36,345 dagen |
| 133Xe | 132,90591 | 5,2475 dagen |
| 135Xe | 134,90722 | 9,14 uur |
| 137Xe | 136,91156 | 3,818 min |
| 138Xe | 137,91395 | 14,08 min |
| 139Xe | 138,91879 | 39,68 s |
| 140Xe | 139,92164 | 13,60 s |
| 141Xe | 140,92665 | 1,73 s |
| 142Xe | 141,92971 | 1,22 s |
| 143Xe | 142,93511 | 0,511 s |
| 144Xe | 143,93851 | 0,388 s |
| 145Xe | 144,94407 | 188 ms |
| 146Xe | 145,94775 | 146 ms |
| 147Xe | 146,95356 | 130 ms |
Bronnen
Xenon komt als sporenelement voor in de atmosfeer van de Aarde. Gemiddeld bevat onze atmosfeer ongeveer 20 ppm xenon. Ook in de atmosfeer is xenon aangetroffen en wel 0,08 ppm.
Xenon kan ook op Aarde worden gevonden. Sommige minerale bronnen stoten xenon uit. Bedrijven halen het gas voor commercieel gebruik uit industriële installaties die het gas uit vloeibare lucht halen.
Xenon kan ook in de Aarde worden aangetroffen. Gebaseerd op kennis over de andere edelgassen vermoeden wetenschappers dat er eigenlijk 90% meer Xenon in de atmosfeer aanwezig zou moeten zijn. Deze ontbrekende “xenonparadox” is al een lang bestaand vraagstuk.
Uiteindelijk is bewijs gevonden dat het ontbrekende gas zich in de kern van de Aarde bevindt. De extreme drukken en temperaturen in de kern van de Aarde kunnen er voor zorgen dat xenon zich hecht aan ijzer en nikkel waardoor het gas daar wordt opgeslagen.
Toepassingen
Als Xenon wordt blootgesteld aan een elektrische lading dan ontstaat er een blauwe of lavendelachtige gloed. Lampen die xenon gebruiken lichten beter op dan conventionele lampen. Stroboscopische lampen, fotografische flitslampjes, booglampen voor filmprojectie, sommige lampen die worden gebruikt voor diepzee-observatie, bacteriedodende lampen, zonnebanklampen en hogedrukbooglampen maken allemaal gebruik van xenon.
Xenon wordt steeds meer gebruikt in koplampen van auto’s. Als je koplampen ziet die een zachtblauwe gloed afgeven dan zijn ze waarschijnlijk gemaakt met xenon.
Maar het gas kent ook nog andere toepassingen. Het wordt gebruikt in kerncentrales en voor het vullen van televisie- en radiobuizen. Silicium-microprocessoren worden geëtst met xenonfluoride. Xenon-ionenvoortstuwingssystemen houden sommige satellieten en andere ruimtevaartuigen in een baan om de Aarde. Xenon wordt zelfs gebruikt voor het maken van medicijnen.
Huidig onderzoek
Er zijn verschillende onderzoeken waarbij xenon wordt gebruikt. Het Xenon Dark Matter Project bijvoorbeeld, experimenteert met een detector van vloeibaar xenon. Hiermee wordt naar donkere materie gezocht. Donkere materie is vermoedelijk de lijm die het heelal bij elkaar houdt. In dit experiment is xenon in een speciale kamer gebracht. Als de deeltjes in de kamer zich anders gedragen dan verwacht dan zou dit een teken kunnen zijn dat er interactie van donkere materie met het deeltje plaatsvindt.
De Large Underground Xenon (LUX) is een ander, vergelijkbaar experiment. Deze donkere materie detector gebruikt ook vloeibare xenon. Ofschoon de beide projecten nog niks hebben gevonden heeft het onderzoek onze ideeën over donkere materie wel vorm gegeven.
Weetjes
- Radioactief 131I kan vervallen tot stabiel xenon, dit gebeurde na de kernramp in Fukushima, Japan.
- Xenon is niet het enige edelgas. Ook helium, argon, neon, krypton en radon zijn edelgassen.
- Je kan ballonnen vullen met xenon, alhoewel dat wel een hele dure aangelegenheid is. Xenon is een erg zwaar gas en je kan in een gemiddelde ballon wel 18 kilogram xenon doen.
- Atomen xenon worden aan vloeibaar helium toegevoegd om kwantumtornado’s te bestuderen.