Neodymium
Inhoudsopgave
Wat is Neodymium?
Neodymium heeft atoomnummer 60 en symbool Nd. Het is een zacht, zilverkleurig lanthanide met een heldere metaalglans. Het metaal komt voor in de mineralen bastnasiet en monaziet. Het komt niet in zijn metaalvorm voor en het is altijd gemend met andere zeldzame aardmetalen. Neodymium is niet zeldzamer dan koper, nikkel of kobalt. Neodymium wordt voornamelijk gewonnen in China. Andere winningsgebieden bevinden zich in Australië, Sri Lanka, India, Brazilië en de Verenigde Staten. De wereld jaarproductie van neodymiumoxide bedraagt ongeveer 7000 ton en de wereldreserve wordt geschat op 8.000.000 ton.
Gegevens
| Symbool | Nd |
| Volledige naam | Neodymium |
| Atoomnummer | 60 |
| Atoommassa (g.mol-1 ) | 144,24 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,14 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,0 |
| Smeltpunt (°C) | 1024 |
| Kookpunt (°C) | 3074 |
| Vanderwaalstraal (nm) | 0,181 |
| Ionstraal (nm) | |
| Isotopen | 9 |
| Elektronenconfiguratie | [Xe]4f4 6s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 533,09 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1035,30 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3132,34 |
| Ontdekt door | Carl Auer von Welsbach in 1885 |
Neodymium kent verschillende verbindingen waaronder hydroxides, sulfides, halides en carbides. Het zijn populaire toevoegingen aan glas en ze worden gebruikt in o.a. lasers die infrarood licht uitzenden. Het element zelf wordt gebruikt in neodymiummagneten, in-ear hoofdtelefoons, professionele luidsprekers en microfoons. Magneten van neodymium zijn sterker, lichter en goedkoper dan samarium-kobalt magneten. Tegelijkertijd hebben ze wel de neiging om te roesten en hun magnetische te verliezen. Ze zijn van mindere kwaliteit dan samarium-kobalt magneten.
Bohr-Rutherford diagram
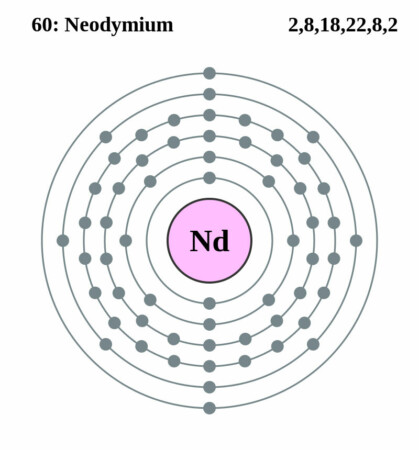
CC BY-SA 2.0 uk, Link
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 60 | Neodymium | 142 Nd | 141,907719 | 27,2 |
| 143 Nd | 142,909810 | 12,2 | ||
| 144 Nd | 143,910083 | 23,8 | ||
| 145 Nd | 144,912569 | 8,3 | ||
| 146 Nd | 145,913112 | 17,2 | ||
| 148 Nd | 147,916889 | 5,7 | ||
| 150 Nd | 149,920887 | 5,6 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 124Nd | 123,95223 | 500 ms |
| 125Nd | 124,94888 | 600 ms |
| 126Nd | 125,94322 | 1 s |
| 127Nd | 126,94050 | 1,8 s |
| 128Nd | 127,93539 | 5 s |
| 129Nd | 128,93319 | 4,9 s |
| 130Nd | 129,92851 | 21 s |
| 131Nd | 130,92725 | 33 s |
| 132Nd | 131,92332 | 1,56 min |
| 133Nd | 132,92235 | 70 s |
| 134Nd | 133,91879 | 8,5 min |
| 135Nd | 134,91818 | 12,4 min |
| 136Nd | 135,91497 | 50,65 min |
| 137Nd | 136,91456 | 38,5 min |
| 138Nd | 137,91195 | 5,04 uur |
| 139Nd | 138,91197 | 29,7 min |
| 140Nd | 139,90955 | 3,37 dagen |
| 141Nd | 140,90961 | 2,49 uur |
| 144Nd | 143,91008 | 2,29 * 1015 jaar |
| 147Nd | 146,91610 | 10,98 dagen |
| 149Nd | 148,92014 | 1,728 uur |
| 150Nd | 149,92089 | 6,7 * 1018 jaar |
| 151Nd | 150,92382 | 12,44 min |
| 152Nd | 151,92468 | 11,4 min |
| 153Nd | 152,92769 | 31,6 s |
| 154Nd | 153,92948 | 25,9 s |
| 155Nd | 154,93293 | 8,9 s |
| 156Nd | 155,93502 | 5,49 s |
| 157Nd | 156,93903 | 2 s |
| 158Nd | 157,94160 | 700 ms |
| 159Nd | 158,94609 | 500 ms |
| 160Nd | 159,94909 | 300 ms |
| 161Nd | 160,95388 | 200 ms |
Toepassingen
Neodymium wordt toegepast in cryokoelers omdat het bij de temperatuur van vloeibaar helium een specifieke warmtecapaciteit heeft. Samarium-neodymium datering wordt gebruikt om de leeftijdsrelatie van meteorieten en gesteente te bepalen. Het scannen van isotopen van neodymium maakt het mogelijk om de sterkte en grootte van vulkanische uitbarstingen te voorspellen. Grote en kleine vulkaanuitbarstingen variëren in termen van isotopensamenstelling. Wetenschappers gebruiken de isotopenbepaling van neodymium om de sterkte van een vulkaanuitbarsting te voorspellen en zo bewoners te waarschuwen voor de kracht van de uitbarsting.
Door het sterke absorptievermogen van neodymium verandert de kleur van glas onder verschillende lichtomstandigheden. Het is groen onder trichromatische verlichting en roodpaars onder geel gloeilicht of daglicht. Dit fenomeen wordt gewaardeerd door verzamelaars. Een mooie kleur rood ontstaat door de combinatie met selenium en goud. Voor de mooiste kleur in glas moeten ijzerhoudende verontreinigingen worden verwijderd.
Neodymium is te vinden in apparatuur zoal spaarlampen, fluorescentielampen, brillen en kleurentelevisies. Het wordt gebruikt in legeringen voor lichtere vuursteentjes. De belangrijkste legeringen van neodymium zijn met boor en ijzer. Er kunnen uitstekende magneten van worden gemaakt. Deze legeringen worden gebruikt in luidsprekers en het datadragers voor het opslaan van computergegevens.
Het element wordt toegevoegd aan didymiumglas dat wordt gebruikt bij de productie van lasbrillen. Het wordt ook aan glas toegevoegd om er grijze, rode en violette kleuren mee te maken. Astronomen gebruiken glas met neodymium om spectrometers te kalibreren. Andere soorten glas worden toegevoegd aan kunstmatige robijnen. Sommige zouten van neodymium worden gebruikt voor het kleuren van glas en email.
Gezondheid & milieu
Na cerium is neodymium het meest voorkomende zeldzame aarde. Het element geeft geen biologische functie en de hoeveelheid neodymium in het menselijk lichaam is erg klein. Neodymiumzouten en stof zijn irriterend door de ogen en de oplosbare zouten zijn licht giftig als ze worden ingeslikt. Het element kan schade toebrengen aan de lever. Neodymium stapelt zich op in waterbodems en bodems en dit leidt tot verhoogde concentraties in bodemdeeltjes, dieren en mensen. Het element kan schade veroorzaken aan celmembranen van waterdieren waardoor voortplantingsorganen en het zenuwstelsel worden aangetast.