Ruthenium
Inhoudsopgave
Herkomst woord
Het woord Ruthenium stamt af van Ruthenia en dat is het Latijnse woord voor Rusland.
Ontdekking
De ontdekking wordt meestal toegeschreven aan Karl Ernst Klaus die het element in 1883 ontdekte. Echter bijna 20 jaar eerder vonden Jöns Berzelius en Gottfried Osann het element al in onzuivere vorm. In 1827 onderzochten ze restanten die waren overgebleven toen de ruwe platina uit de Russische Oeral oplosten. Osann dacht drie nieuwe metalen te hebben gevonden en eentje noemde hij Ruthenium. In 1844 toonde Klaus aan dat het rutheniumoxide van Osann erg onzuiver was en dat het nieuwe metaal een oxide was. Van het in aqua regia onoplosbare deel ruwe platina verkreeg Klaus 6 gram ruthenium.
Chemische gegevens
| Symbool | Ru |
| Volledige naam | Ruthenium |
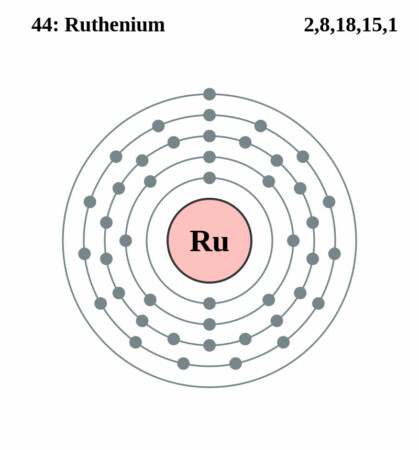
| Atoomnummer | 44 |
| Atoommassa (g.mol-1 ) | 101,07 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 2,2 |
| Dichtheid (g.cm-3 bij 20 °C) | 12,45 |
| Smeltpunt (°C) | 2334 |
| Kookpunt (°C) | 4150 |
| Vanderwaalsstraal (nm) | 0,135 |
| Ionstraal | — |
| Isotopen | — |
| Elektronenschil | [Kr]4d75s1 |
| Elektronen per schil | 2, 8, 18, 15, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 710,2 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1620 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2747 |
| Standaard potentiaal (V) | 0,45 |
| Ontdekt door: | 1844 door Carl Ernst Klaus |
Eigenschappen van Ruthenium
Ruthenium is een lid van de platinagroep. Het is een hard, wit transitiemetaal. Het wordt niet dof bij kamertemperaturen maar het oxideert explosief. Het kan worden aangevallen door halogenen en hydroxides. Er zijn vier kristalstructuren bekend. Het kan worden neergeslagen als een laagje door middel van elektrodedepositie of thermische decompositiemethodes. Het is een krachtig legeringsmiddel, een veelzijdige katalysator en het verbetert de corrosiebestendigheid van legeringen. Wetenschappers hebben ten minste 8 oxidatietoestanden gevonden. Van deze oxidatietoestanden komen 2, 3 en 4 het meeste voor. Rutheniumtetroxide is zeer giftig en kan exploderen. Rutheniumverbindingen lijken heel erg op cadmiumverbindingen.
Bohr-Rutherford diagram
Bronnen van Ruthenium
Net zoals de andere leden van de platina groep komt ruthenium van nature voor in minerale afzettingen in de Oeral en in Noord- en Zuid-Amerika. Het is ook aangetroffen in pyroxiniet-afzettingen in Zuid-Afrika. Om het voor commercieel gebruik te isoleren zijn er verschillende complexe chemische bewerkingen nodig. De laatste stap is een waterstofreductie van ammonium rutheniumchloride. Dit leidt tot een poeder dat kan worden gewonnen.
Toepassingen van Ruthenium
Ruthenium toevoegen is een van de meest effectieve manieren om platina en palladium harder te maken. Het wordt ook gelegeerd met deze metalen om elektrische geleiders te maken die extreem slijtvast zijn. Een ruthenium-molybdeenlegering zou supergeleidend zijn bij 10,6 Kelvin (-262,5 °C). De corrosieweerstand van titanium wordt verhonderdvoudigd door toevoeging van 0,1% Ruthenium.
Ruthenium is een veelzijdige katalysator. Het kan gebruikt worden om met behulp van licht waterstofsulfide (H2S) te splitsen in een waterige suspensie van Cadmiumsulfide (CdS)-deeltjes geladen met rutheniumoxide. Dit vermogen kan helpen om H2S te verwijderen tijdens de raffinage van olie en andere industriële processen.
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 44 | Ruthenium | 96 Ru | 95,907598 | 5,54 |
| 98 Ru | 97,905287 | 1,87 | ||
| 99 Ru | 98,905939 | 12,76 | ||
| 100 Ru | 99,904220 | 12,60 | ||
| 101 Ru | 100,905582 | 17,06 | ||
| 102 Ru | 101,904350 | 31,55 | ||
| 104 Ru | 103,905430 | 18,62 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 87Ru | 86,94918 | 50 ms |
| 88Ru | 87,94026 | 1,3 s |
| 89Ru | 88,93611 | 1,38 s |
| 90Ru | 89,92989 | 11,7 s |
| 91Ru | 90,92629 | 7,9 s |
| 92Ru | 91,92012 | 3,65 min |
| 93Ru | 92,91705 | 59,7 s |
| 94Ru | 93,91136 | 51,8 min |
| 95Ru | 94,91041 | 1,643 uur |
| 97Ru | 96,90755 | 2,791 dagen |
| 103Ru | 102,9063) | 39,26 dagen |
| 105Ru | 104,9077 | 4,44 uur |
| 106Ru | 105,90732 | 373,59 dagen |
| 107Ru | 106,90991 | 3,75 min |
| 108Ru | 107,91017 | 4,55 min |
| 109Ru | 108,91320 | 34,5 s |
| 110Ru | 109,91414 | 11,6 s |
| 111Ru | 110,91770 | 2,12 s |
| 112Ru | 111,91897 | 1,75 s |
| 113Ru | 112,92249 | 0,80 s |
| 115Ru | 114,92869 | 740 ms |
| 116Ru | 115,93081 | 400 ms |
| 117Ru | 116,93558 | 300 ms |
| 118Ru | 117,93782 | 200 ms |
| 119Ru | 118,94284 | 170 ms |
| 120Ru | 119,94531 | 80 ms |
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30