Technetium
Inhoudsopgave
Herkomst woord
Het woord Technetium is afkomstig van het Griekse “Technetos” en dat betekent “kunstmatig”.
| Symbool | Tc |
| Volledige naam | Technetium |
| Atoomnummer | 43 |
| Atoommassa (g.mol-1 ) | 98 |
| Groep | Transitiemetalen |
| Elektronegativiteit (Pauling) | 1,9 |
| Dichtheid (g.cm-3 bij 20 °C) | 11,5 |
| Smeltpunt (°C) | 2157 |
| Kookpunt (°C) | 4265 |
| Vanderwaalsstraal (nm) | 0,128 |
| Ionstraal (nm) | |
| Isotopen | |
| Elektronenschil | [Kr]4d65s1 |
| Elektronen per schil | 2, 8, 18, 13, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 702 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1470 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2850 |
| Ontdekt door: | 1937 door Emilio Segrè en Carlo Perrier |
Bohr-Rutherford diagram
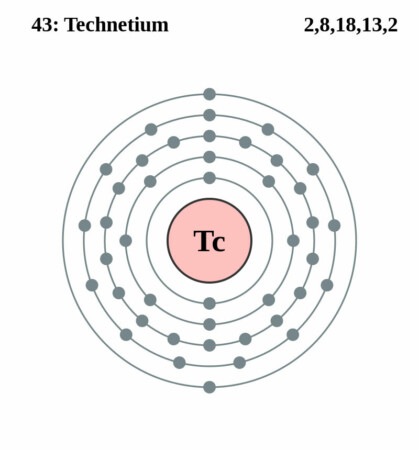
By Pumbaa (original work by Greg Robson) – generated by script, CC BY-SA 2.0 uk,
Ontdekking
Technetium is het eerste element dat kunstmatig is gemaakt. Element 43 werd voorspeld op basis van een leegte in het periodiek systeem der elementen. In 1925 werd, foutief, de ontdekking ervan aangekondigd. Het element werd toen Masurium genoemd.
Technetium werd in 1937 door Perrier en Segre in Italië voor het eerst geproduceerd. Het werd ook aangetroffen in een monster van molybdeen dat in een deeltjesversneller met deuteronen was gebombardeerd. Deuteronen zijn de atoomkernen bestaande uit een proton en een neutron. Ze zijn de eenwaardige kationen van deuterium en dat is weer een isotoop van waterstof.
Sinds de ontdekking van technetium zochten onderzoekers naar het element in de natuur. Het duurde tot 1962 toen het isotoop 99 Tc werd geïsoleerd en geïdentificeerd in Afrikaans uraniumerts. Het is een spontaan splijtingsproduct van uranium.
Eigenschappen van Technetium
Technetium is een zilvergrijs transitiemetaal. In vochtige lucht wordt het heel langzaam dof van kleur. Het lost op in salpeterzuur, aqua regia en geconcentreerd zwavelzuur maar het is niet op te lossen in zoutzuur.
Technetium wordt voornamelijk kunstmatig verkregen. Het is een product dat in kernreactors vrijkomt bij de kernsplijting van uranium. Technetium heeft als oxidatietoestanden +7, +5 en +4. Onder oxiderende omstandigheden kan technetium (VII) ook voorkomen als pertechnaat (TcO4-)
Technetium kan chemisch aan heel veel biologische actieve moleculen worden gebonden. Alle vormen van technetium zijn radioactief.
Bronnen van Technetium
Technetium wordt hoofdzakelijk kunstmatig verkregen. Van nature komt technetium in hele kleine concentraties voor. Het is aangetroffen in het spectrum van S- , M- en N-type sterren. De aanwezigheid van technetium in deze spectra heeft geleid tot nieuwe theorieën over het ontstaan van zware elementen in sterren.
Een van de isotopen, 99 Tc werd in 1962 gevonden als een van de producten van de splijting van uranium in nucleaire reactoren. Gedurende de jaren zijn er op deze manier redelijke hoeveelheden technetium geproduceerd. Er moet voorzichtig met 99 Tc worden gewerkt.
Toepassingen van Technetium
Technetium is een opmerkelijke corrossieremmer voor staal. Milde staalsoorten kunnen met slechts 55 ppm KTcO4 in belucht gedestilleerd water bij temperaturen tot 250 °C worden beschermd, Deze corrossiebescherming is beperkt tot gesloten systemen want technetium is radioactief en moet daarom worden afgeschermd.
Bij temperaturen van 11 Kelvin (-262,1 °C) is technetium ook een uitstekende supergeleider.
Het isotoop 95 Tc (halfwaardetijd = 61 dagen) wordt gebruikt als tracer. Het isotoop 99 Tc (halfwaardetijd = 6,01 uur) is echter het meest nuttige isotoop. Het wordt vanwege zijn korte halfwaardetijd, gammastralenenergie en vermogen om aan biologisch actieve moleculen te binden, gebruikt in veel medische radioactieve isotopenonderzoeken.
Isotopen van Technetium
Er zijn 35 isotopen van technetium bekend en ze zijn allemaal radioactief. Het is een van de slechts twee elementen met een atoommassa < 83 die geen stabiele isotopen heeft (het andere element is promethium). De isotopen variëren van 85 tot 118.
Drie isotopen van technetium hebben een lange halfwaardetijd: 97 Tc heeft een halfwaardetijd van 2,6 * 106 jaar, 98 Tc heeft een halfwaardetijd van 4,2 * 106 jaar en 99 Tc heeft een halfwaardetijd van 2,1 * 105 jaar.
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 86Tc | 85,94288 | 55 ms |
| 87Tc | 86,93653 | 2,18 s |
| 88Tc | 87,93268 | 5,8 s |
| 89Tc | 88,92717 | 12,8 s |
| 90Tc | 89,92356 | 8,7 s |
| 91Tc | 90,91843 | 3,14 min |
| 92Tc | 91,91526 | 4,25 min |
| 93Tc | 92,91024 | 2,75 uur |
| 94Tc | 93,90965 | 293 min |
| 95Tc | 94,90765 | 20,0 uur |
| 96Tc | 95,90787 | 4,28 dagen |
| 97Tc | 96,90636 | 2,6 * 106 jaar |
| 98Tc | 97,90721 | 4,12 * 106 jaar |
| 99Tc | 98,90625 | 2,111 * 105 jaar |
| 100Tc | 99,907657 | 15,8 s |
| 101Tc | 100,90731 | 14,22 min |
| 102Tc | 101,90921 | 5,28 s |
| 103Tc | 102,90918 | 54,2 s |
| 104Tc | 103,91145 | 18,3 min |
| 105Tc | 104,91166 | 7,6 min |
| 106Tc | 105,91435 | 35,6 s |
| 107Tc | 106,91508 | 21,2 s |
| 108Tc | 107,91846 | 5,17 s |
| 109Tc | 108,91998 | 860 ms |
| 110Tc | 109,92382 | 0,92 s |
| 111Tc | 110,92569 | 290 ms |
| 112Tc | 111,92915 | 290 ms |
| 113Tc | 112,93159 | 170 ms |
| 114Tc | 113,93588 | 150 ms |
| 115Tc | 114,93869 | 100 ms |
| 116Tc | 115,94337 | 90 ms |
| 117Tc | 116,94648 | 40 ms |
| 118Tc | 117,95148 | 30 ms |