Zirkonium
Inhoudsopgave
Zirkonium is een zilvergrijs overgangsmetaal, Het is een type metaal dat vervormbaar en buigzaam is en gemakkelijk stabiele verbindingen vormt. Het is ook zeer goed bestand tegen corrosie. Zirkonium en zijn legeringen worden al eeuwenlang op verschillende manieren gebruikt.
Het wordt vaak in corrosieve omgevingen gebruikt. Zirkoniumlegeringen zijn te vinden in buizen, fittingen en warmtewisselaars. Ook wordt zirkonium toegepast in staallegeringen, gekleurd glazuur, bakstenen, keramiek, schuurmiddelen, flitslampen, lampfilamenten, kunstmatige edelstenen en in sommige deodorants.
Andere toepassingen van zirkonium zijn onder andere in katalysatoren, ovenstenen, laboratoriumkroezen, chirurgische instrumenten, televisieglas. Zirkonium wordt gebruikt voor het verwijderen van restgassen uit vacuümbuizen en als verhardingsmiddel in legeringen zoals staal. Zirkoniumcarbonaat kan gebruikt worden om contact-allergische reacties die worden veroorzaakt door het sap van de gifsumak te bestrijden.
Zirkonium is aangetroffen in sterren van het S-type, de Zon, meteorieten en in maanrotsen. Maangesteente lijkt een verrassend hoog zirkoongehalte te ebben in vergelijking met aards gesteente. Dit blijkt uit analyses van de verschillende stenen die tijdens de Apollo-missies naar de Aarde zijn gehaald.
Op Aarde wordt zirkonium voornamelijk gewonnen uit de mineralen zirkoon en baddeleyiet (Zirkoniumoxide). De Verenigde Staten, Rusland, Australië, Brazilië, Zuid-Afrika en Sri Lanka zijn grote producenten van zirkonium. De aardkorst bevat gemiddeld ongeveer 165 ppm zirkonium.
Chemische gegevens
| Symbool | Zr |
| Volledige naam | Zirkonium |
| Atoomnummer | 40 |
| Atoommassa (g.mol-1 ) | 91,22 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 1,33 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,52 |
| Smeltpunt (°C) | 1855 |
| Kookpunt (°C) | 4377 |
| Vanderwaalsstraal (nm) | 0,160 |
| Ionstraal (nm) | 0,08 (+4) |
| Isotopen | 25 waarvan 5 stabiel |
| Elektronenschil | [Ar]4d25s2 |
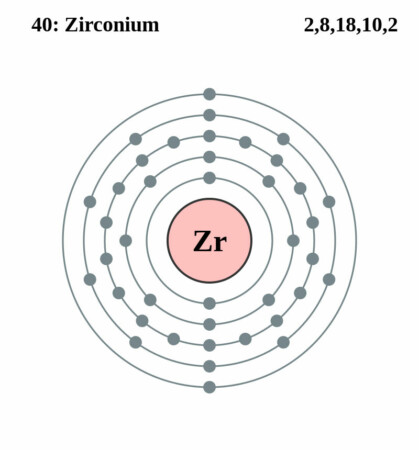
| Elektronen per schil | 2, 8, 18, 10, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 640,1 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1270 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2218 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1789 door Martin Heinrich Klaproth |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 40 | Zirconium | 90 Zr | 89,904704 | 51,45 |
| 91 Zr | 90,905645 | 11,22 | ||
| 92 Zr | 91,905040 | 17,15 | ||
| 94 Zr | 93,906316 | 17,38 | ||
| 96 Zr | 95,908276 | 2,80 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 78Zr | 77,95523 | 50 ms |
| 79Zr | 78,94916 | 56 ms |
| 80Zr | 79,94040 | 4,6 s |
| 81Zr | 80,93721 | 5,5 s |
| 82Zr | 81,93109 | 32 s |
| 83Zr | 82,92865 | 41,6 s |
| 84Zr | 83,92325 | 25,9 min |
| 85Zr | 84,92147 | 7,86 min |
| 86Zr | 85,91647 | 16,5 uur |
| 87Zr | 86,91481 | 1,68 uur |
| 88Zr | 87,91022 | 83,4 dagen |
| 89Zr | 88,90889 | 78,41 uur |
| 93Zr | 92,90647 | 1,53 * 106 jaar |
| 95Zr | 94,90804 | 64,032 dagen |
| 96Zr | 95,90827 | 20 * 1018 jaar |
| 97Zr | 96,91095 | 16,744 uur |
| 98Zr | 97,91273 | 30,7 s |
| 99Zr | 98,91651 | 2,1 s |
| 100Zr | 99,91776 | 7,1 s |
| 101Zr | 100,9211 | 2,3 s |
| 102Zr | 101,9229 | 2,9 s |
| 103Zr | 102,9266 | 1,3 s |
| 104Zr | 103,9287 | 1,2 s |
| 105Zr | 104,9330 | 0,6 s |
| 106Zr | 105,9359 | 200 ms |
| 107Zr | 106,9407 | 150 ms |
| 108Zr | 107,9439 | 80 ms |
| 109Zr | 108,9492 | 60 ms |
| 110Zr | 109,9528 | 30 ms |
Geschiedenis
Zirkoon is een edelsteen die verkrijgbaar is in blauw, geel, groen, bruin, oranje en soms paarse kleuren. Het woord is afkomstig van het Perzische “zargun” dat “goudkleur” betekent. Het wordt al eeuwenlang in sieraden en andere decoraties gebruikt. Zirkoon lijkt meer op diamant dan enige andere natuurlijke edelsteen. In de Middeleeuwen geloofde men dat zirkoon slaap opwekte, zorgde voor rijkdom, eer en wijsheid en dat het plagen en boze geesten verdreef.
De Duitse chemicus Martin Heinrich Klaproth ontdekt in 1789 zirkonium in zirkoon die uit Sri Lanka afkomstig was. Dat monster bestond voor 25% uit silicium, 0,5% IJzeroxide en 70% van een nieuw oxide dar hij “Zirkon erde” (zirkoonaarde) noemde. Hij vond het later ook terug in jacinth. Dit is een lichtgele variant van zirkoon. Klaproth kon het metaal niet scheiden.
In 1808 probeerde de Engelse chemicus Sir Humphry Davy om, door middel van elektrolyse, zirkoonaarde te scheiden om zo zuiver zirkonium te verkrijgen maar zijn pogingen mislukten. Het stelde echter wel de naam zirkonium voor het metaal voor.
In 1824 slaagde de Zweedse chemicus Jöns Berzelius er in om zirkonium te isoleren. Hij verhitte in een ijzeren buis een mengsel van kalium en kaliumzirkoniumfluoride K2 ZrF6). Dit resulteerde in een zwart poeder van zirkonium.
In 1925 slaagden de Nederlandse chemici Anton van Arkel en Jan Hendrik de Boer er in op zuiver zirkonium te produceren door zirkoniumtetrachloride (ZrCl4) te verhitten met magnesium. Deze methode leverde een staaf van zuiver zirkoniumkristal op.
Weetjes
- Zirkoon wordt vaak verward met zirkonia. Dit is een goedkope synthetische diamantsoort. Het zijn echter twee totaal andere stoffen en ze hebben geen verband met elkaar behalve dat ze beiden het element zirkonium in hun chemische structuur hebben.
- Jaarlijks wordt er wereldwijd ongeveer 7000 ton zirkonium geproduceerd.
- Zirkonium combineert samen met silicaat tot de halfedelsteen zirkoon. Zirkonium gecombineerd met dioxide vormt kubistisch zirkonia en dat wordt vaak gebruikt als goedkope vervanging voor diamanten.
- Zirkonium heeft een lage toxiciteit en er wordt geschat dat de mens ongeveer 50 microgram per dag binnenkrijgt. Dit verlaat via de spijsvertering het lichaam zonder te worden geabsorbeerd.
- Het menselijk lichaam bevat ongeveer 0,000001% zirkonium.
- Mogelijk kan lithiumzirkonaat gebruikt worden om op grote schaal CO2 uit de atmosfeer te absorberen.
- In 2000 werd in Australië zirkoonhoudend gesteente gevonden dat met behulp van zuurstofisotopendatering (16O/18O) op 4,4 miljoen jaar oud werd geschat. Het toonde aan dat leven op Aarde vermoedelijk bijna 500 miljoen jaar eerder begon dan eerder werd aangenomen.
- Zirkoniumpoeder kan spontaan ontbranden aan de lucht en om deze eigenschap wordt poedervormig zirkonium soms gebruikt in explosieven.
- Bij kortdurende blootstelling kan zirkoniumpoeder leiden tot irritatie aan de ogen en bij herhaaldelijke blootstelling of lange-termijn blootstelling kan het ook schade aan de longen veroorzaken.
Huidig onderzoek
Vanwege zijn hoge tolerantie tegen corrosie en zijn sterkte wordt zirkonium in verschillende medische hulpmiddelen gebruikt. Eind jaren ’60 begon men heupprotheses te ontwikkelen waarin zirkoniumoxide (ZrO2) in is verwerkt als alternatief voor titanium, staal en aluminium. Deze protheses bleken veerkrachtiger te zijn en voor veel minder afstotingsverschijnselen te zorgen.
Zirkoniumoxide wordt veel gebruikt in de taalheelkundige om gebitten te restaureren. Het wordt vaak gestabiliseerd met yttriumoxide tot ZrO2Y2O3. Deze yttriumoxide-zirkoniumoxide verbinding heeft veel voordelen boven andere materialen. Het is beter geschikt voor het menselijk lichaam en het heeft twee keer de buigsterkte en vier keer de compressieweerstand van staal. Het heeft ook een grotere weerstand tegen zuren en basen die in veel voedingsmiddelen worden aangetroffen.
Hoewel zirkonium en andere elementen in legeringen voor tandheelkundig en medisch gebruik niet giftig zijn, zijn er wel nog steeds onderzoeken nodig om er voor te zorgen dat de materialen ook op de lange termijn geen nadelige bijwerkingen hebben. Een Italiaanse onderzoeksgroep rapporteerde in 2016 een mogelijk verband tussen zwaarlijvigheid en zirkoniumimplantaten. Deze groep patiënten vertoonde meer ontstekingen en skelet- en bindweefselaandoeningen. Een exacte oorzaak heeft men niet kunnen achterhalen maar de studie gaf wel meer inzichten in de wondgenezing en de gastheer-implantaatintegratie.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30