Rhodium
Inhoudsopgave
Rhodium is een zilverwit metaal dat sterk reflecteert en bestand is tegen corrosie. Het wordt beschouwd als het zeldzaamste en meest waardevolle edelmetaal ter wereld. De naam rhodium komt van het Griekse woord “rhodon”, wat roze betekent, genoemd naar de rozerode kleur van zijn zouten.
Chemische gegevens
| Symbool | Rh |
| Volledige naam | Rhodium |
| Atoomnummer | 45 |
| Atoommassa (g.mol-1 ) | 102,90550 |
| Groep | transitiemetalen |
| Elektronegativiteit (Pauling) | 2,28 |
| Dichtheid (g.cm-3 bij 20 °C) | 12,41 |
| Smeltpunt (°C) | 1964 |
| Kookpunt (°C) | 3695 |
| Vanderwaalsstraal (nm) | — |
| Ionstraal (nm) | — |
| Isotopen | 1 |
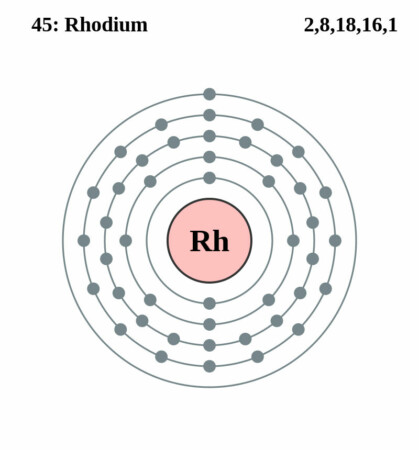
| Elektronenschil | [Kr]4d85s1 |
| Elektronen per schil | 2, 8, 18, 16, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 719,7 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1740 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2997 |
| Standaard potentiaal (V) | 0,6 |
| Ontdekt door: | 1804 door William Hyde Wollaston |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 45 | Rhodium | 103 Rh | 102,905504 | 100 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 89Rh | 88,94884 | 10 ms |
| 90Rh | 89,94287 | 15 ms |
| 91Rh | 90,93655 | 1,74 s |
| 92Rh | 91,93198 | 4,3 s |
| 93Rh | 92,92574 | 11,9 s |
| 94Rh | 93,92170 | 70,6 s |
| 95Rh | 94,91590 | 5,02 min |
| 96Rh | 95,91446 | 9,90 min |
| 97Rh | 96,91134 | 30,7 min |
| 98Rh | 97,91070 | 8,72 min |
| 99Rh | 98,90813 | 16,1 dagen |
| 100Rh | 99,90812 | 20,8 uur |
| 101Rh | 100,9061 | 3,17 jaar |
| 102Rh | 101,90684 | 207,0 dagen |
| 104Rh | 103,90665 | 42,3 s |
| 105Rh | 104,90569 | 35,36 uur |
| 106Rh | 105,90728 | 29,80 s |
| 107Rh | 106,90674 | 21,7 min |
| 108Rh | 107,90873 | 16,8 s |
| 109Rh | 108,90873 | 80 s |
| 110Rh | 109,91114 | 28,5 s |
| 111Rh | 110,91159 | 11 s |
| 112Rh | 111,91439 | 3,45 s |
| 113Rh | 112,91553 | 2,80 s |
| 114Rh | 113,91881 | 1,85 s |
| 115Rh | 114,92033 | 0,99 s |
| 116Rh | 115,92406 | 0,68 s |
| 117Rh | 116,92598 | 0,44 s |
| 118Rh | 117,93007 | 310 ms |
| 119Rh | 118,93211 | 300 ms |
| 120Rh | 119,93641 | 200 ms |
| 121Rh | 120,93872 | 100 ms |
| 122Rh | 121,94321 | 50 ms |
Eigenschappen
Rhodium is een van de zes metalen uit de platinagroep: platina, palladium, rhodium, osmium, iridium en ruthenium. Het is ook geclassificeerd als een edelmetaal. Het werkt als een katalysator en het is bestand tegen corrosie en oxidatie. Enkele gemeenschappelijke kernmerken uit de platinagroep zijn onder meer hoge smeltpunten, algemene niet-toxiciteit en weerstand tegen slijtage, oxidatie en corrosie.
Rhodium is het zeldzaamste metaal uit de platinagroep en komt slechts tot 1/200 miljoenste voor in de aardkorst. Rhodium heeft een lagere dichtheid en een hoger smeltpunt dan platina. Rhodium is tot een temperatuur van 600 °C bestand tegen aantasting door lucht en water.
Ontdekking
Rhodium werd in 1803 ontdekt door de Engelse chemicus William Hyde Wollaston. Kort hiervoor had hij ook het element palladium ontdekt. Wollaston haalde rhodium uit een stuk platina-erts dat hij uit Zuid-Amerika had gehaald. Rhodium komt vaak voor bij afzettingen van platina en het wordt gewoonlijk verkregen tijdens de winning en zuivering van platina.
Wollaston werd voor het eerst geattendeerd op de mogelijkheid van een nieuw element in platina-erts door de Franse chemicus Hippolyte-Victor Collet-Descotils die geloofde dat de rode kleur van sommige platinazouten te wijten was aan de aanwezigheid van een niet-geïdentificeerd element. Na een reeks chemische reacties was Wollaston in staat om het platina en palladium uit het monster platina-erts te verwijderen. Hij bleef achter met een donkerrood poeder dat natriumrhodiumchloride bleek te zijn.
Toepassingen
Rhodium wordt voornamelijk gebruikt in katalysatoren die zijn ontworpen om de uitstoot van voertuigen te verminderen. Rhodium, vaak samen met palladium en/of platina, doet dit door stikstofoxides in uitlaatgassen te verminderen. Zonder rhodiumkatalysatoren zou de lucht in onze steden veel slechter zijn door uitlaatgassen van voertuigen.
Omdat rhodium vrij helder is en bestand tegen aanslag wordt het gebruikt als afwerking van sieraden, zoeklichten en spiegels. Gelegeerd met platina wordt het toegepast in turbinemotoren voor vliegtuigen. In de chemische industrie wordt rhodium gebruikt als katalysator bij het maken van salpeterzuur, azijnzuur en hydrogeneringsreacties. Andere toepassingen voor rhodium zijn het coaten van optische vezels, smeltkroezen, thermokoppelelementen en reflectoren in koplampen. Omdat het een lage elektrische weerstand heeft en zeer goed bestand is tegen corrosie wordt het ook als elektrisch contactmateriaal gebruikt.
Rhodium wordt vaak gelegeerd met platina en iridium om zo een oxidatiebestendig metaal te maken dat bestand is tegen hoge temperaturen. Deze legeringen worden gebruikt in ovenwikkelingen, penpunten, grammofoonnaalden, hoge-temperatuurthermokoppels en weerstandsdraden, elektroden voor vliegtuigbougies, lagers en elektrische contacten.
Rhodium heeft geen bekend biologisch gebruik en geen bekend gebruik in processen voor leven. Hoewel sommige verbindingen van rhodium kankerverwekkend zijn, zijn er bijna geen gevallen gemeld waarbij mensen op enigerlei wijze door dit element werden beïnvloed. Dit kan zijn omdat rhodiumverbindingen zo zelden worden aangetroffen. Testen op planten hebben aangetoond dat rhodium het minst giftige lid is van de platinagroep van metalen.
In de natuur komt slechts één stabiel isotoop voor: 103Rh.
Weetjes
Een legering van rhodium-platina wordt gebruikt in pacemakers.
Rodium is bestand tegen de meeste zuren.
Rhodium wordt zelden als metaal gebruikt en bijna altijd als een legering.
Van de drie edelmetalen (rhodium, platina, palladium) die momenteel worden gebruikt in katalysatoren voor voertuigen heeft rhodium veruit de grootste activiteit bij het verwijderen van stikstofoxides (NOx). Het heeft ook een zeer hoge activiteit voor het oxideren van koolwaterstoffen (HC) en koolmonoxide (CO) en een zeer goede weerstand tegen de gifstoffen die in de uitlaatstroom aanwezig zijn. Het belangrijkste nadeel van rhodium is de hoge prijs.
Winning
Commercieel rhodium wordt over het algemeen verkregen als een bijproduct bij het zuiveren van koper en nikkel. In de natuur kan rhodium vrij of met andere platinametalen voorkomen.
Vanwege de zeldzaamheid, de kleine marktomvang en het geconcentreerde aanbod, Zuid-Afrika is goed voor ongeveer 80% van alle rhodium die wordt geproduceerd, zijn de prijzen doorgaans volatiel.
Opslaan van zonne-energie
Hoewel rhodium een solide niche in de industrie lijkt te hebben gevonden in het reinigen van uitlaatgassen van auto’s, tonen veel nieuwe onderzoeksprojecten aan dat het edelmetaal veel meer potentieel heeft, vooral in zijn primaire rol als katalysator.
In een van die onderzoeken hebben wetenschappers een nieuw chemisch proces ontwikkelt dat thermische energie van de Zon gebruikt om kooldioxide en water om te zetten in energierijke brandstoffen. Dit chemische proces omvat een nieuwe materiaalcombinatie van ceriumoxide en kleine hoeveelheden rhodium als katalysator. Hun ontdekking is een belangrijke stap in de richting van de chemische opslag van zonne-energie.