Radon
Inhoudsopgave
Radon is een radioactief, kleurloos, reuk- en smaakloos gas dat van nature voorkomt als het vervalproduct van de elementen radium, thorium en uranium. Het is een edelgas en dat betekent dat het chemisch inactief is en alleen onder extreme omstandigheden met andere stoffen reageert. Het is het zwaarste bekende gas en vanwege de radioactiviteit wordt het als een gevaar voor de gezondheid beschouwt.
Radon is in de natuur zeldzaam en dat komt doordat de isotopen ervan een korte halfwaardetijd hebben en omdat de belangrijkste bron radium ook vrij zeldzaam is. Radon heeft geen bekend biologisch doel maar er wordt verondersteld dat het ene belangrijke rol heeft gespeeld in de evolutie aangezien er straling is vereist om genetische modificaties te laten plaatsvinden.
Chemische gegevens
| Symbool | Rn |
| Volledige naam | Radon |
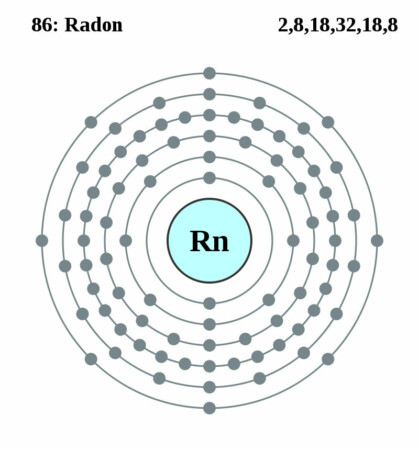
| Atoomnummer | 86 |
| Atoommassa (g.mol-1 ) | 222 |
| Groep | edelgas |
| Elektronegativiteit (Pauling) | 2,2 |
| Dichtheid (g/l bij 20 °C) | 9,73 |
| Smeltpunt (°C) | -71 |
| Kookpunt (°C) | -61,7 |
| Vanderwaalsstraal (nm) | 0,220 |
| Ionstraal | — |
| Isotopen | 3 natuurlijke isotopen |
| Elektronenschil | [Xe]4f145d106s26p6 |
| Elektronen per schil | 2, 8, 18, 32, 18, 8 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 1037 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | — |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1900 Friedrich Ernst Dorn |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 86 | Radon | 222 Rn | 222,017570 | * |
| 220 Rn | 220,011394 | * | ||
| 211 Rn | 211,990601 | * |
*Alle natuurlijke isotopen van radon zijn radioactief
radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 195Rn | 195,00544 | 6 ms |
| 196Rn | 196,00211 | 4,7 ms |
| 197Rn | 197,00158 | 66 ms |
| 198Rn | 197,99867 | 65 ms |
| 199Rn | 198,99837 | 620 ms |
| 200Rn | 199,99569 | 0,96 s |
| 201Rn | 200,99563 | 7,0 s |
| 202Rn | 201,99326 | 9,94 s |
| 203Rn | 202,99338 | 44,2 s |
| 204Rn | 203,99142 | 1,17 min |
| 205Rn | 204,99172 | 170 s |
| 206Rn | 205,99021 | 5,67 min |
| 207Rn | 206,99073 | 9,25 min |
| 208Rn | 207,98964 | 24,35 min |
| 209Rn | 208,99041 | 28,5 min |
| 210Rn | 209,98969 | 2,4 uur |
| 211Rn | 210,99060 | 14,6 uur |
| 212Rn | 211,99070 | 23,9 min |
| 213Rn | 212,99388 | 19,5 ms |
| 217Rn | 217,00392 | 0,54 ms |
| 218Rn | 218,00560 | 35 ms |
| 219Rn | 219,00948 | 3,96 s |
| 220Rn | 220,01139 | 55,6 s |
| 221Rn | 221,01553 | 25,7 min |
| 222Rn | 222,01757 | 3,8235 dagen |
| 223Rn | 223,02179 | 24,3 min |
| 224Rn | 224,02409 | 107 min |
| 225Rn | 225,02844 | 4,66 min |
| 226Rn | 226,03089 | 7,4 min |
| 227Rn | 227,03541 | 20,8 s |
| 228Rn | 228,03799 | 65 s |
| 229Rn | 229,04265 | 12 s |
Bohr – Rutherford diagram
Ontdekking
Radon is in 1900 ontdekt door de Duitse chemicus Friedrich Ernst Dorn. Hij ontdekte het nieuwe gas toen hij de vervalketen van radium bestudeerde. Hij noemde het nieuwe gas “radium emanatie”. Radium was pas twee jaar eerder ontdekt door de Nobelprijswinnaar Marie Curie.
De Schotse chemicus Sir William Ramsey, hij won in 1904 de Nobelprijs voor de Chemie, onderzocht de eigenschappen van radon nog verder. Met behulp van de Engelse chemicus Robert Whytlaw Grey isoleerde hij radon en berekende hij de dichtheid ervan zodat het correct in het periodiek systeem kon worden opgenomen. Ze ontdekten dat het het zwaarste gas was dat ooit was gevonden. Ze noemden het gas “niton”, naar het Latijnse woord voor glanzend (nitens). Maar deze naam bleef niet lang in gebruik en omstreeks 1923 was het gas overal ter wereld bekend als radon.
Gevaar
Radon is bijna overal in de lucht aanwezig en iedereen ademt elke dag radon in. Op lage niveaus is het onschadelijk. Mensen die grote hoeveelheden radon inademen lopen echter een verhoogd risico op het ontwikkelen van longkanker.
Onder niet-rokers is radon nummer 1 oorzaak van longkanker en het wordt in de Verenigde Staten geassocieerd met ongeveer 21.000 sterfgevallen door longkanker per jaar. Hiervan hebben er ongeveer 2900 nooit gerookt.
Ongeveer een op de 15 huizen in de Verenigde Staten heeft verhoogde radonniveaus. Het geurloze gas kan via scheuren in muren, vloer en funderingen woningen binnendringen. Radon komt ook vrij uit bouwmaterialen of via water dat afkomstig is van met radon besmette bronnen. In goed geïsoleerde huizen en gebouwen kunnen de niveaus van radon hoger zijn. Als er is gebouwd op grond die rijk is aan de radioactieve elementen thorium, uranium en radium kan er meer radon worden gemeten.
Weetjes
Radon was het vijfde radioactieve element dat werd ontdekt. Eerder al waren de radioactieve elementen uranium, thorium, radium en polonium gevonden.
Radongas is kleurloos maar bij temperaturen onder nul straalt het een heldere gele fosforescentie uit (dit is licht dat wordt uitgezonden door een stof zonder een waarneembare warmte).
Tientallen jaren geleden werden daar in zouten gemengd met verf zodat ze in het donker oplichtend. Nadat radon als een gezondheidsrisico werd gezien werd hiermee gestopt.
Honderden jaren geleden was er een vernietigende ziekte onder mijnwerkers bekend: mala metallorum. In 1879 werd de aandoening geïdentificeerd als longkanker veroorzaakt door blootstelling aan radioactieve stoffen, waaronder radon en uranium.
Verassend onderzoek: is radon in lage doses gezond?
Al duizenden jaren baden mensen in natuurlijke warmwaterbronnen voor de therapeutische eigenschappen van dit water. Veel van deze kuuroorden blijken radon te bevatten. En toch, in plaats van stralingsziekte of kanker te ontwikkelen beweren velen dat baden in het radonrijke grondwater ontstekingen en pijn verminderd.
Radon werd soms ook door ziekenhuizen gebruikt om kanker en andere ziektes te behandelen. Ziekenhuizen produceerden zelf radon door het uit een radiumbron te pompen en het te verzegelen in kleine buisjes. Deze buisjes werden in de buurt van tumoren geplaatst. Dit wordt tegenwoordig nauwelijks nog toegepast.