Cadmium
Inhoudsopgave
Cadmium is een blauwachtig-wit metaal dat kneedbaar en taai is en dat gemakkelijk met een mes kan worden gesneden. Vanwege zijn uitstekende eigenschappen als elektrische geleider wordt cadmium vaak gebruikt bij het galvaniseren en in batterijen. Cadmium en oplossingen van zijn verbindingen zijn giftig en moeten voorzichtig worden behandeld.
Chemische gegevens
| Symbool | Cd |
| Volledige naam | Cadmium |
| Atoomnummer | 48 |
| Atoommassa (g.mol-1 ) | 112,414 |
| Groep | transitiemetaal |
| Elektronegativiteit (Pauling) | 1,69 |
| Dichtheid (g.cm-3 bij 20 °C) | 8,65 |
| Smeltpunt (°C) | 321 |
| Kookpunt (°C) | 767 |
| Vanderwaalsstraal (nm) | 0,158 |
| Ionstraal (nm) | 0,097 (+2) |
| Isotopen | 15 |
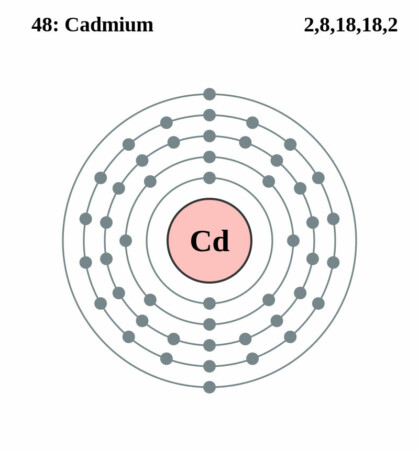
| Elektronenschil | [Kr]4d105s2 |
| Elektronen per schil | 2, 8, 18, 18, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 867,8 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1631,4 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3616 |
| Standaard potentiaal (V) | -0,402 |
| Ontdekt door: | 1817 door Friedrich Strohmeyer |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 48 | Cadmium | 106 Cd | 105,906458 | 1,25 |
| 108 Cd | 107,904183 | 0,89 | ||
| 110 Cd | 109,903006 | 12,49 | ||
| 111 Cd | 110,904182 | 12,80 | ||
| 112 Cd | 111,902757 | 24,13 | ||
| 113 Cd | 112,904401 | 12,22 | ||
| 114 Cd | 113,903358 | 28,73 | ||
| 116 Cd | 115,904755 | 7,49 |
Radioisotopen
| Symbool | Atoommassa (u) | Halfwaardetijd |
| 95 Cd | 94,94987 | 5 ms |
| 96 Cd | 95,93977 | 1 s |
| 97 Cd | 96,93494 | 2,8 s |
| 98 Cd | 97,92740 | 9,2 s |
| 99 Cd | 98,92501 | 16 s |
| 100 Cd | 99,92029 | 49,1 s |
| 101 Cd | 100,91868 | 1,36 min |
| 102 Cd | 101,91446 | 5,5 min |
| 103 Cd | 102,913419 | 7,3 min |
| 104 Cd | 103,909849 | 57,7 min |
| 105 Cd | 104,909468 | 55,5 min |
| 107 Cd | 106,906618 | 6,50 uur |
| 109 Cd | 108,904982 | 461,4 d |
| 113 Cd | 112,9044017 | 7,7 * 1015 jaar |
| 115 Cd | 114,9054310 | 53,46 uur |
| 116 Cd | 115,904756 | 3,1 * 1019 jaar |
| 117 Cd | 116,907219 | 2,49 uur |
| 118 Cd | 117,906915 | 50,3 min |
| 119 Cd | 118,90992 | 2,69 min |
| 120 Cd | 119,90985 | 50,80 s |
| 121 Cd | 120,91298 | 13,5 s |
| 122 Cd | 121,91333 | 5,24 s |
| 123 Cd | 122,91700 | 2,10 s |
| 124 Cd | 123,91765 | 1,25 s |
| 125 Cd | 124,92125 | 0,65 s |
| 126 Cd | 125,92235 | 0,515 s |
| 127 Cd | 126,92644 | 0,37 s |
| 128 Cd | 127,92776 | 0,28 s |
| 129 Cd | 128,93215 | 242 ms |
| 130 Cd | 129,9339 | 162 ms |
| 131 Cd | 130,94067 | 68 ms |
| 132 Cd | 131,94555 | 97 ms |
Geschiedenis
In 1817 ontdekte de Duitse chemicus Friedrich Strohmeyer het element cadmium maar onafhankelijk van hem ontdekten ook de Duitse chemici K. Hermann en J. Roloff in dat jaar het element. In beide gevallen werd cadmium aangetroffen in zinkoxide. Deze verbinding werd in die tijd als medicijn gebruikt.
Strohmeyer inspecteerde in die tijd apotheken in Duitsland. Hij ontdekte dat verschillende apotheken in Hildesheim zinkcarbonaat gebruikten in plaats van zinkoxide. Hij nam verschillende monsters van het zinkcarbonaat om te verhitten en om te zetten in zinkoxide. Hierbij merkte hij op dat verschillende monsters geel opgloeiden. De monsters werden getest op ijzer- of loodverontreinigingen. Dit zijn namelijk typische boosdoeners die dergelijke kleurveranderingen kunnen veroorzaken. Er werden geen sporen van deze elementen gevonden en na verder onderzoek ontdekte Strohmeyer dat er sporen van een onbekend element aanwezig waren. Hij isoleerde het nieuwe metaal en stelde de naam “cadmia” voor. Dit is afgeleid van de Latijnse naam voor calamine (zinkcarboniet).
Strohmeyer vond ook cadmium in veel andere zinkverbindingen waaronder verschillende monsters die zogenaamd puur zink waren. Hij schatte dat cadmium tussen 0,1 en 1 procent puur zink en zinkverbindingen bevat.
Het duurde tot de Industriële Revolutie in het midden van de 19de eeuw voordat men wist dat cadmium giftig is. In die tijd nam het winnen en produceren van cadmium en andere metalen sterk toe. In dezelfde tijd werd cadmium gebruikt in sommige medicijnen en veel mensen die deze medicatie innamen werden er door vergiftigd. Dat is de reden dat Strohmeyer en anderen erop uit werden gestuurd om apotheken te controleren.
In 1945 werden inwoners van de Japanse provincie Toyama ernstig ziek. Ze kregen pijn in hun botten en gewrichten. Er werd vastgesteld dat verhoogd cadmiumconcentraties in het water hiervan de oorzaak waren. Dit water werd gebruikt om de rijstvelden te irrigeren en het was afkomstig uit nabijgelegen zinkmijnen. Toen de gewassen, en dan voornamelijk rijst, de verhoogde cadmiumgehaltes aan de bevolking doorgaven zorgde dit metaal ervoor dat de hoeveelheid calcium in de botten en de dichtheid van de botten afnam. Dit leidde in sommige gevallen zelfs bij simpele bewegingen al tot botbreuken.
Bronnen van cadmium
Cadmium komt niet overvloedig voor in de natuur. Greenockiet is het enige mineraal van betekenis dat cadmium bevat. Cadmium wordt meestal in kleine hoeveelheden aangetroffen in zinkertsen zoals sfaleriet (ZnS).
Mineraalafzettingen van Cadmium zijn o.a. te vinden in Colorado, Illinois, Missouri, Washington en Utah maar ook in Bolivia, Guatemala, Hongarije en Kazachstan. Bijna al het cadmium dat wordt gebruikt is een bijproduct van de behandeling van zink-, koper- en loodertsen. Tegenwoordig wordt cadmium vooral geproduceerd op plaatsen waar zink wordt geraffineerd in plaats van gedolven. Topproducenten van cadmium zijn o.a. China, Japan, Mexico, Korea, de Verenigde Staten, Nederland, India, het Verenigd Koninkrijk, Peru en Duitsland.
Toepassingen van cadmium
In 1927 werd door de International Conference on Weights and Measures de definitie van de meter bepaald aan de hand van de golflengte van een spectraallijn van rood cadmium. Deze definitie wordt overigens tegenwoordig niet meer gebruikt.
Cadmium wordt gebruikt in oplaadbare nikkelcadmiumbatterijen en is te vinden in veel apparaten waaronder mobiele telefoons, draadloze elektrische gereedschappen, camera’s, computers en in noodstroomvoorzieningen en lampen. Het wordt ook gebruikt in kernreactorstaven om kernsplijtingsreacties onder controle te houden vanwege het vermogen om neutronen te absorberen.
Ongeveer 83% van de gewonnen cadmium wordt gebruikt in batterijen, 8% in pigmenten, 7% in coatings en platings, 1% als stabilisator voor plastics en 1% in non-ferrolegeringen, fotovoltaïsche apparaten en ander gebruik.
Weetjes
- De korst van de Aarde bevat 150 ppm cadmium. Het wordt typisch samen aangetroffen met zink. De beide elementen hebben overeenkomstige eigenschappen.
- De naam cadmium komt van het Latijnse woord cadmia en het Griekse woord kadmeia. Dit zijn oude namen voor calamine (zinkcarboniet of ZnCO3).
- Cadmium werd gebruikt als pigment in rode, oranje en gele verven. Dit levert heel heldere kleuren op.
- Vincent van Gogh was een grootverbruiker van met cadmium gepigmenteerde verven en hij gebruikte verschillende rode, gele en oranje tinten.
- Tot de Eerste Wereldoorlog was Duitsland de enige leverancier van cadmium.
- Cadmium komt in zinkertsen voor in verhoudingen van zink staat tot cadmium is 200:1 tot 400:1.
- Cadmium is giftig en kan leiden tot cadmiumvergiftigingen.
Gevolgen voor de gezondheid en het milieu
Cadmium kan verschillende gezondheidseffecten veroorzaken waaronder buikpijn, ernstig braken, diarree, botbreuken, psychische stoornissen, kanker en schade aan het voortplantingssysteem, centraal zenuwstelsel, immuunsysteem en mogelijk het DNA.
Mensen en dieren worden voornamelijk aan cadmium blootgesteld via voedsel, water en roken. Wie direct met cadmium werkt wordt ook via de inademing blootgesteld.
Voedingsmiddelen zoals bladgroenten, aardappelen, granen, pinda’s, sojabonen, zonnebloempitten en tabaksbladeren bevatten relatief veel cadmium; ± 0,05 tot 0,12 mg cadmium per kilogram product. Gewoonlijk hebben niet-rokers gemiddeld 0,38 microgram cadmium per liter bloed. Bij sommige groepen rokers zijn gehaltes van 1,6 microgram cadmium per liter bloed gevonden. Cadmium concentreert zich in de nieren en de lever en kan vele jaren aanwezig blijven. Cadmium verlaat heel langzaam via de urine en ontlasting het lichaam.
Cadmiumafval van de industrie concentreert zich voornamelijk in de bodem. Kleine hoeveelheden komen via verbranding van fossiele brandstoffen in de lucht terecht en via afvalwater komt cadmium in het water terecht. Cadmium kan in de voedselketen terechtkomen doordat planten het via de bodem absorberen. Organismen die in de grond leve zoals wormen zijn zeer vatbaar voor een cadmiumvergiftiging die het hele ecosysteem ernstig kan aantasten.
Het zeeleven en dan vooral het leven in zoet water, waaronder mosselen, oesters, garnalen, kreeften en vissen, zijn vatbaar voor een cadmiumvergiftiging.
Huidig onderzoek
Omdat cadmium een kankerverwekkende stof is wordt er veel onderzoek gedaan naar hoe cadmium de gezondheid precies beïnvloedt. Naast kanker en andere hierboven genoemde effecten zijn er aanwijzingen dat blootstelling aan cadmium verband kan houden met obesitas.
Uit studies is gebleken dat blootstelling aan cadmium en andere zware metalen, waaronder lood, het risico op zwaarlijvigheid kan vergroten.