Calcium
Inhoudsopgave
Calcium is het bekendste constructiemateriaal van de natuur. Calcium is voor alle levende wezens een noodzakelijk bestanddeel en is is ook in overvloed aanwezig in veel niet-levende dingen zoals aarde en water. Tanden, zeeschelpen, botten en stalactieten in grotten zijn allemaal calciumproducten.
Calcium lijkt overal op de vijfde plaats te komen: het is het vijfde meest voorkomende element in de aardkorst (na zuurstof, silicium, aluminium en ijzer); het vijfde meest voorkomende opgeloste ion in zeewater (na natrium, chloride, magnesium en sulfaat) en het vijfde meest voorkomende element in het menselijk lichaam (na zuurstof, koolstof, waterstof en stikstof). Het is echter het meest voorkomende metalen element in het menselijk lichaam; 99% van al het calcium is te vinden in onze botten en tanden.
In zijn zuivere elementaire vorm is calcium een zacht zilverwit aardalkalimetaal. Het is echter belangrijk te weten dat calcium in de natuur nooit in zuivere vorm wordt aangetroffen maar altijd in verbindingen. Calciumverbindingen zijn te vinden in een verscheidenheid aan mineralen waaronder kalksteen (calciumcarbonaat), gips (calciumsulfaat) en fluoriet (calciumfluoride). Calcium maakt ongeveer 4,2 massa-% uit van de aardkorst.
Om zuiver calcium te verkrijgen zal het geëxtraheerd moeten worden door middel van elektrolyse. Dit is een techniek waarbij een elektrische gelijkstroom wordt gebruikt om elementen te scheiden van hun natuurlijk voorkomende bronnen. Eenmaal geïsoleerd is calcium vrij reactief en zal het een grijsachtig witte oxide- en nitridecoating vormen bij blootstelling aan de lucht.
Calcium (Ca) is nummer 20 in het periodiek systeem der elementen en het staat net onder magnesium in dezelfde kolom (groep IIA) als de andere aardalkalimetalen (een groep metalen die chemisch reactiever zijn dan de meeste metalen). Calcium komt van het Latijnse woord “calx”, dit betekent kalk en het is een verwijzing naar calciumoxide (CaO), het nuttige bouwmateriaal dat wordt gewonnen uit verhitte kalksteen.
Ontdekking
In 1808 was het de chemicus en uitvinder Sir Humphry Davy die als eerste met succes calcium wist te isoleren. Een paar andere wetenschappers, Magnus Pontin en Jöns Berzelius waren in de buurt gekomen; ze waren in staat geweest om een calciumamalgaam te produceren door elektrolyse uit te voeren op een mengsel van kalk en kwikoxide. Deze keer herhaalde Davy hun elektrolysemethode op hetzelfde calciumamalgaam maar hij voegde meer kalk toe aan het mengsel waardoor hij meer amalgaam produceerde waaruit hij het kwik kon destilleren. Hierdoor bleef er alleen calcium over.
Nadat calcium met succes was geïsoleerd kon men het element verder bestuderen. Men leerde al snel dat calcium van essentieel belang is voor alle levende wezens.
Chemische gegevens
| Symbool | Ca |
| Volledige naam | calcium |
| Atoomnummer | 20 |
| Atoommassa (g.mol-1 ) | 40,078 |
| Groep | aardalkalimetalen |
| Elektronegativiteit (Pauling) | 1,00 |
| Dichtheid (g.cm-3 bij 20 °C) | 1,55 |
| Smeltpunt (°C) | 842 |
| Kookpunt (°C) | 1484 |
| Vanderwaalsstraal (nm) | 0,231 |
| Ionstraal (nm) | 0,099 |
| Isotopen | 5 natuurlijke isotopen |
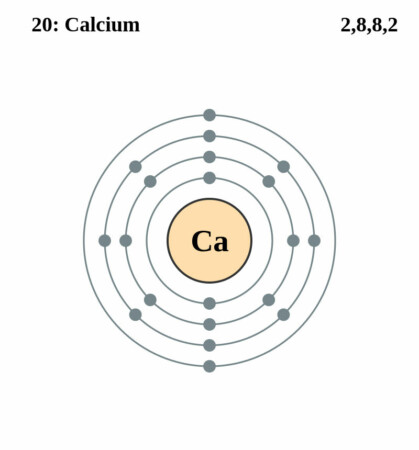
| Elektronenschil | [Ar]4s2 |
| Elektronen per schil | 2, 8, 8, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 589,8 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1145,4 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 4912,4 |
| Standaard potentiaal (V) | -2,87 |
| Ontdekt door | 1808 door Humphry Davy |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 20 | Calcium | 40 Ca | 39,962591 | 96,941 |
| 42 Ca | 41,958618 | 0,647 | ||
| 43 Ca | 42,958767 | 0,135 | ||
| 44 Ca | 43,955481 | 2,086 | ||
| 46 Ca | 45,953693 | 0,004 | ||
| 48 Ca | 47,952534 | 0,187 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 34Ca | 34,01412 | < 35 ns |
| 35Ca | 35,00494 | 25,7 ms |
| 36Ca | 35,99309 | 102 ms |
| 37Ca | 36,98587 | 181,1 ms |
| 38Ca | 37,97631 | 440 ms |
| 39Ca | 38,97071 | 859,6 ms |
| 41Ca | 40,96227 | 1,02 * 105 jaar |
| 45Ca | 44,95618 | 162,67 d |
| 47Ca | 46,95454 | 4,536 d |
| 48Ca | 47,95253 | 43 * 1018 jaar |
| 49Ca | 48,95567 | 8,718 min |
| 50Ca | 49,95751 | 13,9 s |
| 51Ca | 50,9615 | 10,0 s |
| 52Ca | 51,96510 | 4,6 s |
| 53Ca | 52,97005 | 90 ms |
| 54Ca | 53,97435 | 50 ms |
| 55Ca | 54,98055 | 30 ms |
| 56Ca | 55,98557 | 10 ms |
| 57Ca | 56,99236 | 5 ms |
Bohr – Rutherford diagram
Essentieel mineraal
Calcium is buitengewoon belangrijk voor het menselijk lichaam. Het is niet alleen van vitaal belang voor botten en tanden maar het helpt ook bij spierbewegingen door berichten van de hersenen naar al onze lichaamsdelen te sturen. Cellen in levende wezens moeten met elkaar communiceren. Calciumionen fingeren als vitale boodschappers tussen deze cellen en zijn nodig in alle meercellige levensvormen. Ze helpen ook bij het vrijkomen van hormonen en enzymen.
In voedsel wordt calcium in de vorm van mineralen aangetroffen. Voedingsmiddelen met een hoog calciumgehalte zijn onder andere zuivelproducten zoals melk, kaas en yoghurt en sommige groenten zoals boerenkool, spinazie en broccoli. Om calcium goed op te kunnen nemen is vitamine D nodig. Ook magnesium zorgt voor een goede opname van calcium in het lichaam. Als we teveel calcium en onvoldoende magnesium innemen dan dit zelfs tot problemen leiden.
Weetjes
Als kalk oftewel calciumoxide wordt blootgesteld aan een zuurstof-waterstofvlam dan produceert dit een helder wit licht. In de jaren 1800, voordat de elektriciteit werd uitgevonden, werd deze stof gebruikt om het theater te verlichten zodat acteurs echt in de schijnwerpers speelden.
Als schildpadden, en dan vooral jonge schildpadden, niet voldoende calcium door hun bloed laten circuleren dan kunnen ze een aandoening krijgen die er voor zorgt dat hun schild verzwakt. Om een schildpad gezond te houden met de verhouding calcium tot fosfor 2:1 zijn. Als het calciumgehalte echter te laag is dan met het mineraal uit hun botten gehaald in een poging om het lichaam te balanceren. Het resultaat is zachte botten en een zwak en vervormd schild en het resulteert vaak in de dood. De ziekte kan worden voorkomen met een goed dieet en voldoende zonlicht (of een andere voor reptielen geschikte verlichting).
Stalactieten en stalagmieten zijn ijspegelvormige formaties die in ondergrondse grotten worden gevonden. Ze ontstaan door opeenhoping van calcietresten. Dit gebeurt als water door de scheuren in het plafond van een kalksteengrot sijpelt, oplost en sporen van calciet (het bouwmateriaal van kalksteen) met zich meedraagt. Terwijl het water van het plafond druppelt begint dit calcietresidu zich op te hopen op de plaatsen van het druppelen. Uiteindelijk resulteert dit in ijspegelvormige stalactieten die aan het plafond van de grot hangen. Het water dat van de stalactieten druipt vormt vervolgens stalagmieten op de grond beneden.
Veel voedingsdeskundigen adviseren een calcium-magnesiumverhouding van 2:1. Maar hoewel ons lichaam meer calcium nodig heeft is de kans groter dat we een magnesium tekort oplopen. Dit komt doordat ons lichaam de neiging heeft om calcium op te slaan en te recyclen terwijl magnesium wordt gebruikt of uitgescheiden en dagelijks moet worden aangevuld.
Calciumcarbonaat is het actieve ingrediënt in veel maagzuurremmers. De alkalische verbinding werkt door het maagzuur dat verantwoordelijk is voor brandend maagzuur en opstoppingen, te neutraliseren
Gezonde aarde
Calcium is niet alleen essentieel voor het menselijk leven het is ook een essentiële voedingsstof voor planten. In de meeste bodemsoorten komt calcium vrij voor planten voor middel van verwering van mineralen. Als aardalkalimetaal speelt calcium een cruciale rol bij het beheersen van de zuurgraad van de bodem.
De beschikbaarheid van calcium kan indirect invloed hebben op veel microbiologische processen die gevoelig zijn voor de pH van de bodem, zoals afbraak, stikstofmineralisatie en nitrificatie.
Calcium is meestal overvloedig aanwezig in de meeste bodems en sommige gebieden hebben van nature hogere of lagere calciumgehaltes. Hoge calciumgehaltes in de bodem worden meestal aangetroffen in droge en semi-droge gebieden waar de potentiële verdamping groter is dan de werkelijke regenval. Bepaalde planten hebben zich aangepast aan calciumrijke en basische bodems en worden calcifielen genoemd. Calciforen daarentegen zijn planten die gedijen in calciumarme en zure bodems,
Als er een pH-onbalans is in de bodem kunnen er problemen optreden. Bodem met een overvloed aan calcium kan ertoe leiden dat de pH te hoog is oftewel alkalisch is. Dit vermindert soms de oplosbaarheid van voedingsstoffen zoals fosfaat en veel micronutriënten. Dit kan dan nadelige gevolgen hebben door de plantengroei. Het grotere probleem zit echter meestal in de grond met te weinig calcium, dit leidt namelijk tot bodemverzuring. Dit kan gebeuren als calcium uit de grond wordt geloogd door hevige regen of zelfs meer problematisch, zure regen.
Tijdens de jaren ’70 en ’80 van de vorige eeuw was zure regen een groot probleem in de bossen van Europa en Noord-Amerika. Als zure regen de bodem bereikt vervangen protonen van deze sterke zuren in de regen de calciumkationen op de uitwisselingsplaatsen en wordt het calcium uit de bodem geloogd.
Zure regen heeft veel bossen gedood omdat de daarmee gepaard gaande verzuring van de bodem resulteerde in een verhoogde oplosbaarheid van aluminium. Aluminium is giftig voor planten als het bepaalde concentraties in de bodem overschrijdt.
Toepassingen
Calciumverbindingen hebben een grote verscheidenheid aan toepassingen, vooral bij het maken van constructiematerialen. Gips, calciumsulfaat (CaSO4) wordt gebruikt bij het maken van gips.
Kalksteen of calciumcarbonaat (CaCO3) wordt direct als constructiemateriaal en indirect in cement gebruikt. Bij verhitting van kalksteen komt kooldioxide vrij waarna ongebluste kalk (calciumoxide, CaO) achterblijft. Als ongebluste kalk wordt gemengd met water dan ontstaat er gebluste kalk (calciumhydroxide, Ca(OH)2) die wordt gebruikt om cement mee te maken. Gebroken kalk wordt ook gebruikt als bodemverbeteraar en als waterbehandelingsmiddel om de zuurgraad te verminderen. Als gebluste kalk wordt gemengd met zand dan trekt het koolstofdioxide aan uit de lucht en verhardt het tot kalkpleister.
Zuiver calciummetaal wordt gebruikt als reductiemiddel bij de bereiding van andere soorten metalen zoals thorium, uranium en zirkonium. Het kan ook gebruikt worden als legeringsmiddel voor aluminium-, koper-, lood- en magnesiumlegeringen of als deoxidatiemiddel, ontzwavelaar en ontkolingsmiddel voor een verscheidenheid aan ferro- en non-ferro legeringen.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30