Strontium
Inhoudsopgave
Strontium is een zacht, zilverkleurig metaal met een aantal toepassingen: het blokkeert röntgenstralen die worden uitgezonden door tv-beeldbuizen. Het doet verf gloeien in het donker en het is verantwoordelijk voor de schitterende rode kleuren in vuurwerk. Strontium speelt ook een belangrijke rol bij het achterhalen van de oorsprong van soorten: antropologen meten de niveaus strontium in botten en tanden om zo de geografische oorsprong van mensen en dieren te bepalen. Hoewel natuurlijk strontium onschadelijk is heeft een van zijn isotopen, 90Sr, een beroerde reputatie want het is een gevaarlijk bijproduct van nucleaire regen.
Hoog reactief
Strontium komt in de natuur vrij veel voor. Het is het 15de meest voorkomende element in de aardkorst. Ongeveer 0,03% van alle stollingsgesteente is strontium. Natuurlijk strontium is een mix van vier stabiele isotopen, 84Sr, 86Sr, 87Sr en 88S. Strontium wordt voornamelijk aangetroffen in de mineralen celestiet en strontianiet.
Net als andere aardalkalimetalen is strontium chemisch sterk reactief en reageert het met zowel lucht als water. Als het bloot wordt gesteld aan lucht dan brandt het met een heldere rode vlam. Gemengd met water ontstaat er waterstof en strontiumhydroxide.
Hoewel natuurlijk strontium stabiel is en niet gevaarlijk voor de gezondheid is het synthetische isotoop 90Sr radioactief en een gevaarlijk onderdeel van nucleaire fall-out.
De wereldwijde voorraad strontium wordt geschat op meer dan 1 miljard ton. China en Spanje zijn de belangrijke wingebieden gevolgd door Mexico, Argentinië en Marokko.
De feiten
| Symbool | Sr |
| Volledige naam | Strontium |
| Atoomnummer | 38 |
| Atoommassa (g.mol-1 ) | 87,62 |
| Groep | Aardalkalimetalen |
| Elektronegativiteit (Pauling) | 0,95 |
| Dichtheid (g.cm-3 bij 20 °C) | 2,65 |
| Smeltpunt (°C) | 777 |
| Kookpunt (°C) | 1377 |
| Vanderwaalstraal (nm) | 0,249 |
| Ionstraal (nm) | 0,113 (+2) |
| Isotopen | 4 stabiel |
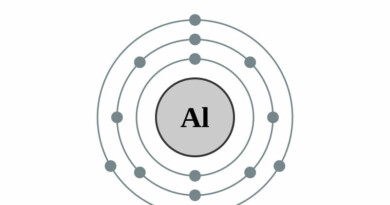
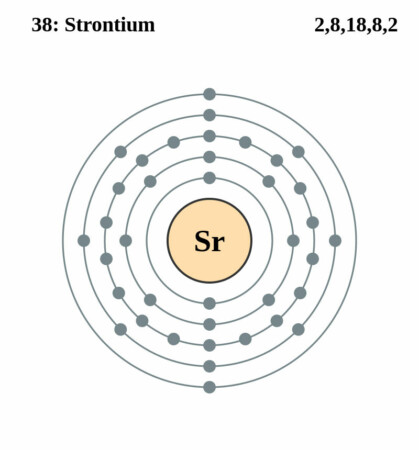
| Elektronen per schil | 2, 8, 18, 8, 2 |
| Elektronenconfiguratie | [Kr]5s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 549,5 |
| Tweede ionisatie potentiaal (kJ.mol-1 ) | 1064,2 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 4138 |
| Standaard potentiaal (V) | — |
| Ontdekt door | 1787 door William Cruickshank |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 38 | Strontium | 84 Sr | 83,913425 | 0,56 |
| 86 Sr | 85,909262 | 9,86 | ||
| 87 Sr | 86,908879 | 7,00 | ||
| 88 Sr | 87,905614 | 82,58 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 73Sr | 72,965 97 | > 25 ms |
| 74Sr | 73,956 31 | 50 ms |
| 75Sr | 74,949 95 | 88 ms |
| 76Sr | 75,941 77 | 7,89 s |
| 77Sr | 76,937 94 | 9,0 s |
| 78Sr | 77,93218 | 159 s |
| 79Sr | 78,929 70 | 2,25 min |
| 80Sr | 79,924 52 | 106,3 min |
| 81Sr | 80,923 21 | 22,3 min |
| 82Sr | 81,918 40 | 25,36 dagen |
| 83Sr | 82,917 55 | 32,41 uur |
| 85Sr | 84,912 93 | 64,853 dagen |
| 89Sr | 88,907 45 | 50,57 dagen |
| 90Sr | 89,907 73 | 28,90 jaar |
| 91Sr | 90,910 20 | 9,63 uur |
| 92Sr | 91,911 03 | 2,66 uur |
| 93Sr | 92,914 02 | 7,423 min |
| 94Sr | 93,915 36 | 75,3 s |
| 95Sr | 94,919 35 | 23,90 s |
| 96Sr | 95,921 69 | 1,07 s |
| 97Sr | 96,926 15 | 429 ms |
| 98Sr | 97,928 45 | 0,653 s |
| 99Sr | 98,933 24 | 0,269 s |
| 100Sr | 99,935 35 | 202 ms |
| 101Sr | 100,940 5 | 118 ms |
| 102Sr | 101,943 0 | 69 ms |
| 103Sr | 102,948 9 | 50 ms |
| 104Sr | 103,952 3 | 30 ms |
| 105Sr | 104,958 5 | 20 ms |
Toepassingen
Fijn verdeeld strontiumpoeder kan bij kamertemperatuur spontaan ontbranden. Strontiumcarbonaat wordt verwerkt in vuurwerk een glow-in-the-dark verf. Strontiumzouten geven een heldere rode kleur af en worden ook gebruikt om vuurwerk te stabiliseren.
Strontium wordt verwerkt in glas dat wordt gebruikt om en kathodestraalbuizen (CRT’s) van te maken. Het zorgt er voor dat deze beeldbuizen geen schadelijke röntgenstraling afgeven. Het gebruik van CRT’s neemt in snel tempo af en dat heeft een aanzienlijke impact op de winning van strontium.
Strontium wordt gebruikt in ferrietmagneten (ijzeroxide gecombineerd met een of meerdere andere metalen) en het wordt toegepast bij het zuiveren van zink. Het element wordt toegepast bij de elektriciteitsopwekking in ruimtesondes, afgelegen weerstations en navigatieboeien. Strontiumhexahydraat is een ingrediënt in tandpasta voor gevoelige tanden.
Ontdekking
In 1787 werd er in een loodmijn in het Schotse Strontian een vreemd stuk gesteente aangetroffen. Het werd overgebracht naar Edinburgh voor inspectie. Het werd geanalyseerd door de Ierse chemicus en natuurkundige Adair Crawford. Velen dachten te maken te hebben met een bariumverbinding maar Crawford ontdekte al snel dat het een nieuw mineraal was met een onbekende samenstelling. Hij noemde het Strontia naar de plek waar het was gevonden.
In 1791 produceerde de Engelse chemicus Thomas Charles Hope een aantal verbindingen met strontium en hij merkte op dat het in een vlam een rode kleur kreeg. Bariumverbindingen zorgen voor een groene kleur dus het moest iets anders zijn. In dezelfde tijd was de Duitse chemicus Martin Heinrich Klaproth ook met testen van het nieuwe materiaal bezig en het lukte hem om zowel strontiumoxide als strontiumhydroxide te produceren.
In 1808 isoleerde de Engelse chemicus en uitvinder Humphry Davy als eerste het element strontium. Hij deed dit door middel van elektrolyse, een methode die hij ook had gebruikt om natrium en kalium te isoleren.
Strontiumdatering
Het meeste strontium ontstaat uit het verval van rubidium. Elk gebied op Aarde heeft zijn eigen unieke verhouding van strontiumionen en die is afhankelijk van de lokale geologie. Deze strontiumionen komen in onze voedsel- en watervoorziening terecht. Omdat strontiumionen chemisch vergelijkbaar zijn met calcium en daarom sterk binden aan calciumgevoelige receptoren kan strontium per ongeluk worden opgenomen in tanden, botten en schelpen en plaats van calcium.
Wetenschappers meten de niveaus van de strontiumisotopen 86Sr en 87Sr in oude tanden, botten of schelpen en vervolgens vergelijken ze de verhouding van deze twee isotopen, hetzij met elkaar of met een ander element zoals calcium of zink, om de plaats van herkomst, het dieet en de leeftijd van de soort te bepalen.
Strontiumonderzoek wordt onder andere ook uitgevoerd in zee. Zo heeft men ontdekt dat schelpen voor elke 1000 calciumatomen slechts een paar strontiumatomen bevatten. Onderzoek heeft aangetoond dat de relatieve niveaus van 86Sr en 87Sr in zeewater in de loop van de tijd zijn veranderd. In de afgelopen 40 miljoen jaar zijn de niveaus van 87Sr in de oceaan gestaag toegenomen.
Aangezien deze twee strontiumisotopen niet vervallen blijft de verhouding die bijvoorbeeld in de schelp van een oud zeedier wordt aangetroffen ongewijzigd, zelfs nadat het dier is gestorven en de schelp een fossiel wordt. Dus zelfs na miljoenen jaren kunnen wetenschappers de ouderdom van zeefossielen bepalen door het strontium te extraheren en de verhouding tussen de twee isotopen af te stemmen op de isotopen waarvan bekend is dat ze in een bepaalde periode in zeewater zijn voorgekomen.
Radioactiviteit en Fukushima
Het isotoop 90Sr is een kernsplijtingsproduct en het komt in het milieu terecht tijdens een nucleaire regen. Strontium-90 heeft een halfwaardetijd van ongeveer 28 jaar. Als hoge niveaus van 90Sr door botweefsel wordt geabsorbeerd in plaats van calcium dan kan het beenmerg worden vernietigd en kan er kanker ontstaan,
Tijdens de nucleaire testen van de Verenigde Staten in de jaren ’40 en ’50 kwam er 90Sr vrij in de lucht. Dit werd uiteindelijk opgenomen in graslanden, koeienmagen en zuivelproducten. In tanden van kinderen was dit in de jaren ’50 te zien. Twee grote nucleaire ongelukken waarbij 90Sr en andere radioactieve elementen in het milieu terechtkwamen waren het ongeluk met de kernreactor in Tsjernobyl in 1987 en de kernramp in Fukushima Daiichi in Japan in 2011.
Het ongeval in Fukushima vond plaats toen een reeks tsunami’s, veroorzaakt door de aardbeving in Tohoku (magnitude 9.0) op 11 maart 2011, de kerncentrale van Fukushima ernstig beschadigde. Vier van de zes kernreactoren raakten beschadigd en gaven straling af in de atmosfeer en de oceaan. Het ongeluk in Fukushima verhoogde het niveau van 90Sr in de Stille Oceaan voor de kust van Japan tot wel 100 keer.
In 2011 werd een internationaal onderzoek gestart om de verspreiding van radionucliden vanuit Fukushima in de Stille Oceaan in kaart te brengen. Uit dit onderzoek blijkt dat de strontiumniveaus rond het ongevalsgebied niet zo snel dalen als verwacht. Maar waar deze niveaus precies zouden moeten zijn en waarom ze nog steeds niet onder controle zijn is een ingewikkelde zaak.
Niemand wist wat men kon verwachten dus terwijl de radioactieve strontiumniveaus afnemen zijn ze nog lang niet terug op het niveau van vóór de ramp. Dit suggereert dat er nog steeds bronnen van radioactief strontium zijn. Dit kunnen de individuele tanklekkages zijn die vooral de eerste paar jaar na 2011 zichtbaar waren. Ook de grondwaterstroom van vervuild water naar de oceaan zal een bron van radioactief strontium kunnen zijn.
Dit onderzoek is van groot belang omdat overtollige niveaus van strontium en andere radioactieve elementen een bedreiging vormen voor mensen en zeedieren. Op dit punt is overigens het vrijkomen van cesium de grootste zorg.
Strontium gedraagt zich net als calcium, het wordt een “botzoekend” element genoemd. Als zodanig heeft het een vrij lange biologische halfwaardetijd. Dat wil zeggen de tijd die het wordt vastgehouden in menselijke en mariene organismes bedraagt meerdere jaren.
Het grootste risico voor mensen is dus de opname van besmette mariene organismes en de ophoping van radioactief strontium in onze botten. Gelukkig was de aanvankelijke uitstoot van radioactief strontium veel kleiner dan de cesiumisotopen. Bovendien zijn tot op heden de niveaus van 90Sr in zeevruchten voor de kust van Japan veel kleiner en dus minder zorgwekkend dan voor cesium.
Weetjes
De eerste grootschalige toepassing van strontium vond plaats in de bietsuikerindustrie net voor de Eerste Wereldoorlog. Destijds werd elk jaar meer dan 100.000 ton strontiumhydroxide gebruikt in het kristallisatieproces van suiker.
Bijna alle strontiumverbindingen worden verwerkt uit het mineraal celestiet. Omdat celestiet vaak ook barium en calcium bevat (waarvan de eigenschappen vergelijkbaar zijn met die van strontium), waardoor het scheidingsproces wordt bemoeilijkt, moet ruwe celestiet vaak meer dan 90% strontiumsulfaat bevatten om de winning aantrekkelijk te maken
Strontium-89 is het actieve ingrediënt in een radiofarmaceuticum dat wordt gebruikt bij patiënten met uitgezaaide botkanker. Het strontium werkt als calcium en wordt opgenomen in de botgebieden met een verhoogde osteogenese. Hierdoor kan straling zich concentreren op het kankergebied.
Strontiumchloride is een actief ingrediënt dat wordt gebruikt in tandpasta’s voor gevoelige tanden. Sommige merken bevatten tot 10% totaal strontiumchloride-hexahydraat per gewicht.
Strontiumtitanaat heeft een extreem hoge brekingsindex en een optische dispersie die groter is dan die van diamant. Het is erg zacht maar toch wordt het soms wel toegepast als edelsteen.
Spectra
Absorptiespectrum
Emissiespectrum
Laatste update: 2021-05-30