Titrimetrie
Inhoudsopgave
Overzicht
Titrimetrie is een laboratoriummethode voor kwantitatieve analyse die wordt gebruikt om een onbekende concentratie van een bekende stof te bepalen. De analyse wordt uitgevoerd met behulp van een buret, een soort laboratoriumglaswerk dat is gemaakt voor de exacte bepaling van het volume van de gebruikte oplossing. Het meest populaire titrimetrische experiment is de bepaling van een hoeveelheid zuur in een oplossing.
Stel je voor dat je een oplossing hebt van een zwavelzuur met een onbekende concentratie.
Giet een afgemeten hoeveelheid zwavelzuur (VH2SO4) in een bekerglas en voeg enkele druppels alcoholische fenolftaleïne-oplossing toe. De oplossing zal kleurloos zijn aangezien fenolftaleïne alleen roze wordt in basische oplossingen (kleur wordt zichtbaar bij een pH boven 8,2).

Gebruik nu een buret om langzaam NaOH-oplossing (de zogenoemde titrant) met een bekende molaire concentratie CNaOH toe te voegen. De pH zal langzaam stijgen. Zodra al het zwavelzuur is geneutraliseerd is het toevoegen van één druppel sterke base voldoende om de pH van de oplossing snel te veranderen en de kleur om te laten slaan naar roze.
Als de kleur van de oplossing verandert dan weet je dat je al het aanwezige zuur hebt geneutraliseerd, je hebt dat het eindpunt van de titratie bereikt. Gebruik de buretschaal om het volume van de gebruikte titrant (VNaOH) af te lezen.
We weten dat één mol H2SO4 reageert met precies twee mol NaOH:
2NaOH + H2SO4 –> Na2SO4 + 2H2O
Omdat we weten dat de hoeveelheid stof van een bepaalde concentratie in een bepaald volume oplossing n = C * V is, kunnen we schrijven:
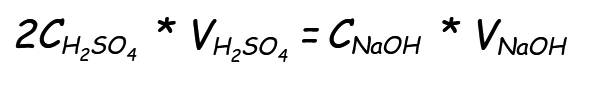
In deze formule is 2 de coëfficiënt die de stoichiometrie van de reactievergelijking weergeeft. In deze vergelijking hebben we slechts één onbekende:
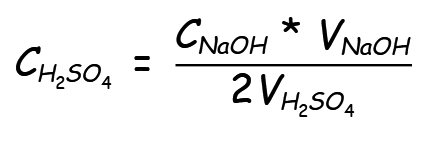
We hebben nu dus de concentratie van de onbekende concentratie zwavelzuur bepaald.
Dergelijke stoichiometrische berekeningen zijn de basis voor alle volumetrische analytische methodes. Ze verschillen als het gaat om de gebruikte reagentia en methodes voor het bepalen van het eindpunt maar het algemene idee is altijd hetzelfde.
Een volumetrische bepaling kan niet beter zijn dan de apparatuur en techniek die bij het uitvoeren ervan worden gebruikt.
Basisbegrippen
Er zijn veel verschillende soorten titraties die verschillen door de gebruikte titrant en stoffen die kunnen worden bepaald. Hoewel elke titratie anders is, hebben ze wel allemaal dezelfde kenmerken. Voor we die gaan bespreken definiëren we eerste een aantal belangrijke termen:
titrant
De titrant is de vloeistof die vanuit een buret wordt toegevoegd. De gebruikte titrant en de reactie die optreedt definiëren gewoonlijk de naam van de titratie – zoals zuur-base titratie als we een sterk zuur (of sterke base) als titrant gebruiken, of redox wanneer de reactie die optreedt van een redox-type is. De naam kan ook veel specifieker zijn, zoals een permanganometrische titratie (ook bekend als manganometrie of permanganometrie) wanneer de titrant kaliumpermanganaat is.
Titratiefractie (of titratiepercentage)
De titratiefractie vertelt ons hoe ver we zijn met de titratie. Op het equivalentiepunt hebben we een stoichiometrische hoeveelheid titrant toegevoegd, zodat de titratiefractie gelijk zal zijn aan 1 (of 100% wanneer het wordt uitgedrukt als titratiepercentage).
Het lijkt misschien handig om het titrantvolume te gebruiken om de voortgang van een titratie te meten maar dat is niet het geval. Het is bijvoorbeeld veel gemakkelijker om te zeggen “een pH bij 50% titratie is gelijk aan de pKa van een monoprotisch zwak zuur” dan om elke keer het toegevoegde volume te berekenen om op hetzelfde punt uit te komen.
Merk op dat in het geval van polyprotische zuren 100% titratie kan betekenen dat alleen het eerste proton volledig is geneutraliseerd, of dat het zuur volledig is geneutraliseerd. Zo wordt, afhankelijk van de gebruikte definitie volledig getitreerd fosforzuur getitreerd op 100% of 300%. Dit laatste zullen we toepassen in onze artikelen over titrimetrie.
Titratie-equivalentiepunt
Het equivalentiepunt is waar de titratie echt zou moeten eindigen, de titratiefractie is er precies gelijk aan 1, dus we hebben een stoichiometrische hoeveelheid titrant toegevoegd aan de getitreerde stof. Dit is echter niet noodzakelijk waar we de titratie beëindigen.
Titratie – eindpunt
Het eindpunt is waar de titratie in de praktijk eindigt. Hoe dichter het eindpunt bij het equivalentiepunt hoe beter maar het is vaak niet eenvoudig om een goede methode voor het detecteren van equivalentiepunten te vinden. Heel vaak kunnen we echter gemakkelijk een punt zien dat heel dicht bij het equivalentiepunt ligt, en dat is waar het eindpunt zal zijn.
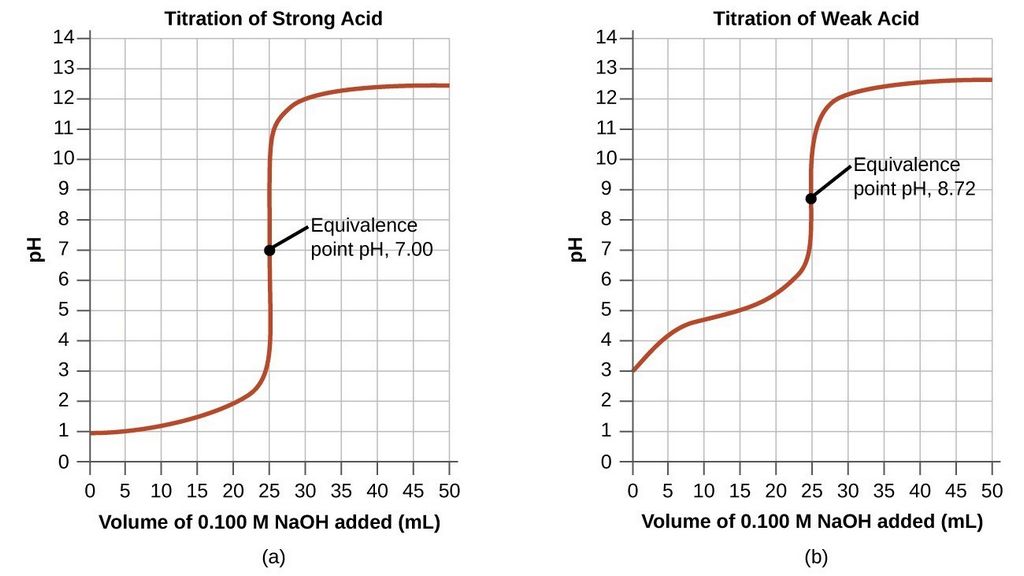
Bij een basische titratie van een sterk zuur met een sterke base ligt het equivalentiepunt bijvoorbeeld bij pH=7,00 maar de meest populaire en handige indicator die wordt gebruikt, fenolftaleïne, begint van kleur te veranderen bij een pH iets boven 8 (in de praktijk kan die verandering veel dichter bij pH=9 worden waargenomen). Bij permanganaattitraties gebruiken we geen speciale indicator omdat de permanganaatoplossing sterk gekleurd is en overtollige titrant gemakkelijk zichtbaar is (vooral als we een wit vel papier achter de kolf plaatsen). In beide gevallen kunnen we de kleur niet zien zonder een kleine overmaat titrant toe te voegen, wat een kleine positieve fout in de titratie introduceert. Zolang deze fout in hetzelfde bereik ligt als de buretprecisie (en precisie waarmee we het volume kunnen aflezen) kunnen we deze fout negeren.
Titratiecurve
De titratiecurve is een grafiek waarin de veranderingen van een geselecteerde eigenschap van een oplossing tijdens titratie worden weergegeven. De selectie van de eigenschap hangt af van de titratie in het geval van een basische titratie zoeken we naar de veranderingen in pH van de oplossing. In het geval van een complexometrische titratie traceren we gewoonlijk veranderingen in metaalconcentratie (met behulp van de logaritme of min-logaritme op de grafiek, aangezien de concentratie zelfs 1010 keer kan veranderen). Tijdens redoxtitraties zoeken we naar de redoxpotentiaal in de oplossing, enzovoort.
De meeste titratiecurves hebben dezelfde vorm: een plateau in het eerste deel en een scherpe stijging (of daling) nabije het equivalentiepunt (buigpunt van de curve), gevolgd door een tweede vlak deel. Het belangrijkste deel van de curve is dat waar de veranderingen het snelst zijn, dicht bij het eindpunt. Doordat veranderingen daar zo snel gaan en zo groot zijn, zijn ze meestal goed waarneembaar. Dat helpt ons op zijn beurt om het eindpunt van de titratie te detecteren.
Soms (afhankelijk van het titratietype en de geselecteerde oplossingseigenschap) kan de titratiecurve een andere vorm hebben. Als we bijvoorbeeld conductometrie (geleidbaarheid) gebruiken om het eindpunt van een alkalimetrische titratie te bepalen meten we niet de pH van de oplossing maar de geleidbaarheid ervan. Titratiecurves hebben in dit geval een V-vorm.
Titratie – eindpunt
Het eindpunt van de titratie is waar we moeten stoppen met toevoegen van titrant.
Voor het beste resultaat moeten we een methode kiezen om het eindpunt te detecteren die garandeert dat het eindpunt zo dicht mogelijk bij het theoretische equivalentiepunt ligt. Zoals we echter zullen laten zien in de sectie “eindpuntdetectie” is het voldoende dat het eindpunt redelijk dicht bij het equivalentiepunt ligt, omdat in de meeste gevallen onze inspanningen om een perfecte eindpuntsdetectiemethode te selecteren verspild zullen zijn, er zal namelijk geen toename zijn van de nauwkeurigheid.
Dat komt omdat in bijna alle titraties de verandering van de waargenomen eigenschap van de oplossing (zoal de pH in het geval van een zuur-basetitratie, of potentiaal in het geval van een redoxtitratie) zeer snel is in de buurt van het equivalentiepunt. Dat betekent dat de benodigde overmaat van het reagens erg klein is, vaak vergelijkbaar met de nauwkeurigheid van de buret, of vergelijkbaar is met de grootte van de kleinste druppel van de titrant die aan de oplossing kan worden toegevoegd. Zo is het in de laboratoriumpraktijk veel handiger om goedkope, stabiele en gemakkelijk te bereiden indicatoren te gebruiken, tegen de prijs van (dubieuze) verhoging van de nauwkeurigheid. Het betekent niet dat je het probleem volledig kunt negeren maar je moet ook niet overdrijven.
De eenvoudigste en meest gebruikelijke methodes voor detectie van eindpunten zijn gebaseerd op de kleurverandering. Het kan een kleurverandering zijn van een indicator die speciaal voor dat doel is toegevoegd of een kleurverandering van een getitreerde stof of een kleurverandering veroorzaakt door de overtollige titrant zelf of de reactie ervan met een andere stof die speciaal voor dat doel aan de oplossing is toegevoegd. In sommige gevallen kan overmatige titrant troebelheid van de oplossing veroorzaken wat ook gemakkelijk is te herkennen.
Eindpunt – indicatoren
Het meest voor de hand liggende voorbeeld is een pH-indicator die wordt gebruikt om het eindpunt van een zuur-basetitratie te bepalen. Dicht bij het equivalentiepunt verandert de pH zeer snel, gewoonlijk met 3-4 pH-eenheden per toegevoegde druppel titrant. Dat is genoeg voor veel indicatoren om volledig van kleur te veranderen (als vuistregel herinner je je misschien dat een verandering van de pH met 2 eenheden meestal voldoende is voor een volledige verandering van kleur). Zie de pH-indicatorentabel voor voorbeelden.
Een soortgelijke situatie doet zich voor bij een potentiometrische titratie. Redox-indicatoren zijn stoffen die van kleur veranderen afhankelijk van de redoxpotentiaal van de oplossing. Nabij het equivalentiepuntverandering van de redoxpotentiaal van de oplossing ligt vaak in het bereik van 03, – 0,4 V. Vuistregel (vergelijkbaar met die gebruikt voor pH-indicatoren) zegt dat een verandering van 120 mV/n (waarbij n het aantal elektronen is dat nodig is om de oxidator te oxideren of te reduceren) in de meeste gevallen voldoende is voor een kleurverandering van de indicator. Voorbeelden van redoxindicatoren zijn fenantroline, difenylamine en methyleenblauw.
In het geval van een complexometrische titratie gebruiken we als indicatoren complexvormers die een andere kleur hebben als ze vrij zijn in de oplossing en een andere kleur als ze een complex vormen met het getitreerde metaal (of metaal dat een titrant gebruikt). Net als in het geval van pH-indicatoren is een verandering van pMe met twee eenheden meestal voldoende voor een volledige kleurverandering. De meest populaire indicatoren zijn eriochroom zwart T en murexide.
Soms kunnen we een indicator gebruiken die niet direct gekoppeld is aan het titratietype. Wanneer we bijvoorbeeld ferrocyanide gebruiken voor een Zn2+ -precipitatietitratie voegt toevoeging van ferrocyanide vóór het starten van de titratie een redoxsysteem toe aan de oplossing en zodra er overtollige ferrocyanide verschijnt verandert het potentieel voldoende om sommige redox-indicatoren van kleur te laten veranderen.
Eerste publicatie: 11 maart 2023