Molybdeen
Inhoudsopgave
Molybdeen is een zilverwit metaal dat taai en zeer corrosiebestendig is. Het heeft een van de hoogste smeltpunten van alle zuivere elementen, alleen de elementen tantaal en wolfraam hebben een hoger smeltpunt. Molybdeen is ook een micronutriënt dat essentieel is voor het leven.
Als een transitiemetaal vormt molybdeen gemakkelijk verbindingen met andere elementen. De aardkorst bevat 1 – 2 ppm molybdeen maar het element wordt niet vrij in de natuur aangetroffen. Het belangrijkste molybdeenerts is molybdeniet (molybdeendisulfide), maar het komt ook voor in wulfeniet (loodmolybdaat) en powelliet (calciummolybdaat).
Het wordt gewonnen als bijproduct bij de winning van koper of wolfraam. Molybdeen wordt voornamelijk gewonnen in de Verenigde Staten, China, Chili en Peru. De wereldjaarproductie bedraagt ongeveer 200.000 ton per jaar.
Chemische gegevens
| Symbool | Mo |
| Volledige naam | Molybdeen |
| Atoomnummer | 42 |
| Atoommassa (g.mol-1 ) | 95,96 |
| Groep | transitiemetaal |
| Elektronegativiteit (Pauling) | 2,16 |
| Dichtheid (g/l bij 20 °C) | 10,28 |
| Smeltpunt (°C) | 2623 |
| Kookpunt (°C) | 4639 |
| Vanderwaalsstraal (nm) | 0,139 |
| Ionstraal (nm) | 0,068 (+4), 0,06 (+6) |
| Isotopen | 5 natuurlijke isotopen |
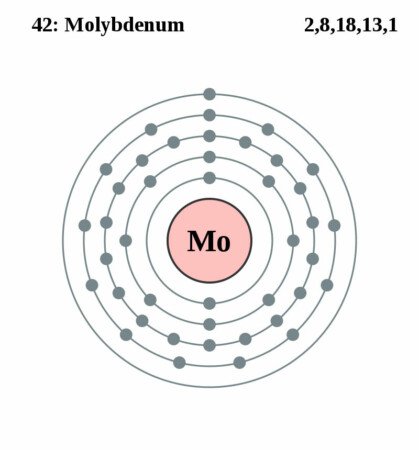
| Elektronenschil | [Kr]4d55s1 |
| Elektronen per schil | 2, 8, 18, 13, 1 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 684,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1560 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2618 |
| Standaard potentiaal (V) | -0,2 |
| Ontdekt door: | 1778 door Carl Wilhelm Scheele |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 42 | Molybdenum | 92 Mo | 91,906810 | 14,84 |
| 94 Mo | 93,905088 | 9,25 | ||
| 95 Mo | 94,905841 | 15,92 | ||
| 96 Mo | 95,904679 | 16,68 | ||
| 97 Mo | 96,906021 | 9,55 | ||
| 98 Mo | 97,905408 | 24,13 | ||
| 100 Mo | 99,907477 | 9,63 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 83Mo | 82,94874 | 23 ms |
| 84Mo | 83,94009 | 3,8 ms |
| 85Mo | 84,93655 | 3,2 s |
| 86Mo | 85,93070 | 19,6 s |
| 87Mo | 86,92733 | 14,05 s |
| 88Mo | 87,92195 | 8,0 min |
| 89Mo | 88,91948 | 2,11 min |
| 90Mo | 89,91393 | 5,56 uur |
| 91Mo | 90,91175 | 15,49 min |
| 93Mo | 92,90681 | 4,0008 jaar |
| 99Mo | 98,90771 | 2,7489 dagen |
| 100Mo | 99,90747 | 8,5 × 1018 jaar |
| 101Mo | 100,9103 | 14,61 min |
| 102Mo | 101,9102 | 11,3 min |
| 103Mo | 102,9132 | 67,5 s |
| 104Mo | 103,9137 | 60 s |
| 105Mo | 104,9169 | 35,6 s |
| 106Mo | 105,9181 | 8,73 s |
| 107Mo | 106,9216 | 3,5 s |
| 108Mo | 107,9234 | 1,09 s |
| 109Mo | 108,9278 | 0,53 s |
| 110Mo | 109,9297 | 0,27 s |
| 111Mo | 110,9344 | 200 ms |
| 112Mo | 111,9368 | 150 ms |
| 113Mo | 112,9418 | 100 ms |
| 114Mo | 113,9449 | 80 ms |
| 115Mo | 114,9502 | 60 ms |
Bohr – Rutherford diagram
Ontdekking
Het zachte zwarte mineraal molybdeniet (molybdeensulfide) werd vaak verward met grafiet of looderts tot in 1778 toen de Duitse chemicus Carl Scheele onthulde dat het geen van deze twee stoffen was maar een totaal nieuw element. Maar aangezien Scheele geen geschikte oven had om de witte vaste stof tot metaal te reduceren zou het nog een paar jaar duren voordat het element daadwerkelijk werd geïdentificeerd. Scheele werd later bekend als “pech-Scheele” omdat hij een aantal chemische ontdekkingen deed, waaronder zuurstof, maar de eer werd altijd aan iemand anders gegeven.
De daaropvolgende jaren bleven wetenschappers aannemen dat molybdeniet een nieuw element bevatte maar het bleek nog steeds erg moeilijk te identificeren aangezien niemand het tot een metaal had kunnen herleiden. Sommige onderzoekers zetten het echter om in een oxide waarop, wanneer het aan water werd toegevoegd, molybdeenzuur werd gevormd maar het metaal zelf bleef ongrijpbaar.
Uiteindelijk vermaalde de Zweedse chemicus Peter Jacob Hjelm molybdeenzuur met koolstof in lijnolie tot een pasta. De pasta zorgde voor nauw contact tussen het koolstof en het molybdeniet. Hjelm verwarmde vervolgens het mengsel in een gesloten smeltkroes om zo het metaal te produceren. Hij noemde dit metaal molybdeen naar het Griekse woord “molybdos” hetgeen lood betekent. Het nieuwe element werd in de herfst van 1781 officieel aangekondigd.
Toepassingen
Molybdeen wordt vaak toegepast bij de productie van legeringen waar het wordt toegevoegd om de hardheid, sterkte, elektrische geleidbaarheid en de weerstand tegen slijtage en corrosie te verhogen.
Kleine hoeveelheden molybdeen zijn te vinden in een grote verscheidenheid aan producten: raketten, motoronderdelen, boren, zaagbladen, elektrische verwarmingsfilamenten, smeermiddeladditieven, inkten voor printplaten en beschermende coatings in boilers. Molybdeen wordt geproduceerd en verkocht als een grijs poeder en veel van zijn producten worden gemaakt door het poeder onder extreem hoge druk samen te persen.
Vanwege zijn hoge smeltpunt presteert het ongelooflijk goed onder zeer hoge temperaturen. Het is vooral handig in producten die onder deze extreme temperaturen gesmeerd moeten blijven. Dus in gevallen waarin sommige smeermiddelen en oliën kunnen ontbinden of vlam vatten kunnen smeermiddelen met molybdeensulfiden de hitte aan en toch zaken in beweging houden.
Weetjes
Molybdeen is het 54ste meest voorkomende element in de aardkorst. Het molybdeenatoom heeft de helft van het atoomgewicht en de dichtheid van wolfraam. Hierdoor vervangt molybdeen vaak wolfraam in legeringen en biedt het hetzelfde metallurgische effect met slechts half zoveel metaal.
Omdat het een veel hoger smeltpunt heeft bevatte het kanon “Dikke Bertha” dat de Duitsers in de Eerste Wereldoorlog gebruikten molybdeen in plaats van ijzer.
Molybdeniet oftewel molybdena is een acht zwart mineraal dat ooit werd gebruikt bij het maken van potloden. Men dacht dat het mineraal lood bevatte en het werd vaak verward met grafiet.
Molybdeniet wordt gebruikt in bepaalde op nikkel gebaseerde legeringen die zeer bestand zijn tegen hoge temperaturen, corrosie en chemische oplossingen.
Micronutriënt
Molybdeen is een micronutriënt die essentieel is voor leven maar in te grote hoeveelheden giftig is.
Molybdeen is aanwezig is tientallen enzymen. Een van deze belangrijke enzymen is nitrogenase waardoor stikstof in de atmosfeer kan worden opgenomen en omgezet in verbindingen waarmee bacteriën, planten, dieren en mensen eiwitten kunnen maken en gebruiken.
Bij mensen is de belangrijkste functie van molybdeen om als katalysator te dienen voor enzymen en om aminozuren in het lichaam af te breken. In planten is molybdeen een essentieel sporenelement dat nodig is voor stikstofbinding en andere metabolische processen.
Molybdeen heeft de unieke eigenschap dat het minder goed oplosbaar is in zure bodems en beter oplosbaar in alkalische bodems (voor andere micronutriënten geldt meestal het tegenovergestelde). Daarom is molybdeen bedoelt voor planten wel heel gevoelig voor pH- en drainageomstandigheden. In alkalische bodems kunnen sommige planten bijvoorbeeld wel 500 ppm molybdeen bevatten. Daarentegen zijn andere gronden onvruchtbaar vanwege een gebrek aan molybdeen in de bodem.
Noodzakelijk voor de evolutie
Molybdeen is ook interessant voor wetenschappelijk onderzoek. Tegenwoordig komt molybdeen veel voor in de oceanen maar dat was in het verleden wel anders. Hierdoor kan het gebruikt worden als indicator voor oude oceanische chemie. Wetenschappers op het gebied van biogeologie bestuderen bijvoorbeeld de hoeveelheid molybdeen in oude gesteenten om aan de hand hiervan te schatten hoeveel zuurstof er gedurende een bepaalde periode in de oceaan en/of atmosfeer aanwezig kan zijn geweest.
Verschillende jaren geleden vermoedden wetenschapper van de universiteit van Californië dat tekorten aan zuurstof en molybdeen mogelijk verantwoordelijk waren voor een grote vertraging in de evolutie. Ze wisten dat er ongeveer 2,4 miljard jaar geleden een toename van zuurstof aan het oppervlak was en dat zuurstof het oppervlak van de oceanen kon bereiken ter ondersteuning van micro-organismes. De diversiteit aan levende organismes bleef echter erg laag. In feite verschenen dieren pas bijna 2 miljard jaar later (ongeveer 600 miljoen jaar geleden).
Als ze geen molybdeen hebben kunnen bacteriën geen stikstof omzetten in een vorm die nuttig is voor levende wezens. En als bacteriën stikstof niet snel genoeg kunnen omzetten dan kunnen eukaryoten niet gedijen omdat deze eencellige levensvormen zelf geen stikstof kunnen omzetten.
Voor hun onderzoek, gepubliceerd in het tijdschrift Nature, maten de onderzoekers de hoeveelheden molybdeen in zwarte schalie. Dit is een soort sedimentair gesteente dat rijk is aan organisch materiaal en vaak diep in de oceaan wordt aangetroffen. Dit hielp hen te schatten hoeveel molybdeen er mogelijk was opgelost in het zeewater waar het sediment zich had gevormd.
De onderzoekers vonden inderdaad een overtuigend bewijs dat de oceaan op dat moment geen significante hoeveelheden molybdeen bevatte. Dit zou een negatieve invloed hebben gehad op de evolutie van vroege eukaryoten waarvan wetenschappers denken dat ze verantwoordelijk zijn voor het ontstaan van alle dieren (inclusief mensen), planeten, schimmels en eencellige dieren.