Hafnium
Inhoudsopgave
Hafnium is een glanzend zilvergrijs transitiemetaal. Het is ontdekt in 1932 en het was het voorlaatste element met stabiele kernen dat aan het periodiek systeem werd toegevoegd ( in 1925 was renium het allerlaatste element). Hafnium is vernoemd naar het Latijnse woord voor Kopenhagen: Hafnia. Het element heeft een aantal zeer belangrijke commerciële toepassingen waaronder in de kernenergie-industrie, elektronische apparatuur, keramiek, gloeilampen en bij het maken van superlegeringen.
Hafnium wordt maar zeer zelden vrij in de natuur aangetroffen. Het is meestal in zirkoniummineralen aanwezig tot een concentratie van 5%. In feite is hafnium chemisch sterk vergelijkbaar met zirkonium. Het scheiden van de beid elementen is buitengewoon lastig. Het meeste commerciële hafnium wordt geproduceerd als bijproduct van de raffinage van zirkonium.
Hafnium is het 45ste meest voorkomende element op Aarde en in de korst van onze planeet bevindt zich gemiddeld ongeveer 3,3 ppm. Hafnium is vrij goed bestand tegen corrosie, dit komt doordat het een oxide vormt op blootgestelde oppervlaktes. In feite wordt het niet beïnvloed door water, lucht en alle logen en zuren behalve waterstoffluoride.
Van alle bekende verbindingen bestaande uit twee elementen heeft hafniumcarbide (HfC) het hoogste smeltpunt (3890 °C). Hafniumnitride (HfN) heeft ook een hoog smeltpunt van ongeveer 3305 °C. onder de verbindingen bestaande uit drie elementen heeft het gemengde carbide van wolfraam en hafnium het hoogste smeltpunt (4125 °C). Enkele andere hafniumverbindingen zijn o.a. hafniumfluoride (HfF4), hafniumchloride (HfCl4) en hafniumoxide (HfO2).
Chemische gegevens
| Symbool | Hf |
| Volledige naam | Hafnium |
| Atoomnummer | 72 |
| Atoommassa (g.mol-1 ) | 178,49 |
| Groep | transitie metaal |
| Elektronegativiteit (Pauling) | 1,3 |
| Dichtheid (g.cm-3 bij 20 °C) | 13,31 |
| Smeltpunt (°C) | 2233 |
| Kookpunt (°C) | 4603 |
| Vanderwaalsstraal (nm) | 0,161 |
| Ionstraal (nm) | 0,075 |
| Isotopen | 6 natuurlijke isotopen |
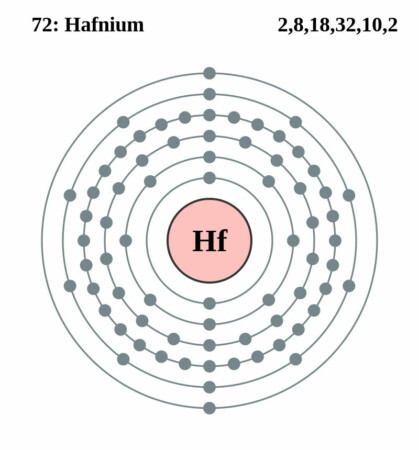
| Elektronenschil | [Xe]4f145d26s2 |
| Elektronen per schil | 2, 8, 18, 32, 10, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 658,5 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1440 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2250 |
| Standaard potentiaal (V) | -1,68 (HfO2+/Hf) |
| Ontdekt door: | 1922 door Dirk Coster en George de Hevesey |
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 72 | Hafnium | 174 Hf | 173,940040 | 0,16 |
| 176 Hf | 175,941402 | 5,26 | ||
| 177 Hf | 176,943220 | 18,60 | ||
| 178 Hf | 177,943698 | 27,28 | ||
| 179 Hf | 178,945815 | 13,62 | ||
| 180 Hf | 179,946549 | 35,08 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 153Hf | 152,97069 | 400 ms |
| 154Hf | 153,96486 | 2 s |
| 155Hf | 154,96339 | 890 ms |
| 156Hf | 155,95936 | 23 ms |
| 157Hf | 156,95840 | 115 ms |
| 158Hf | 157,95479 | 2,84 s |
| 159Hf | 158,95399 | 5,20 s |
| 160Hf | 159,95068 | 13,6 s |
| 161Hf | 160,95027 | 18,2 s |
| 162Hf | 161,94721 | 39,4 s |
| 163Hf | 162,94709 | 40,0 s |
| 164Hf | 163,94436 | 111 s |
| 165Hf | 164,94457 | 76 s |
| 166Hf | 165,94218 | 6,77 min |
| 167Hf | 166,94260 | 2,05 min |
| 168Hf | 167,94057 | 25,95 min |
| 169Hf | 168,94126 | 3,24 min |
| 170Hf | 169,93961 | 16,01 uur |
| 171Hf | 170,94049 | 12,1 uur |
| 172Hf | 171,93944 | 1,87 jaar |
| 173Hf | 172,94051 | 23,6 uur |
| 174Hf | 173,94004 | 2,0 * 1015 jaar |
| 175Hf | 174,94150 | 70 dagen |
| 181Hf | 180,94910 | 42,39 dagen |
| 182Hf | 181,95055 | 8,90 * 106 jaar |
| 183Hf | 182,95353 | 1,067 uur |
| 184Hf | 183,95545 | 4,12 uur |
| 185Hf | 184,95882 | 3,5 min |
| 186Hf | 185,96089 | 2,6 min |
| 187Hf | 186,96459 | 30 s |
| 188Hf | 187,96685 | 20 s |
Ontdekking
Het bestaan van hafnium was al tientallen jaren voor de ontdekking ervan voorspeld. Het element bleek tamelijk ongrijpbaar te zijn, het was namelijk bijna onmogelijk om chemisch onderscheid te maken tussen hafnium en het veel meer voorkomende zirkonium.
Toen de Russische chemicus Dimitri Mendeleev in 1869 zijn periodiek systeem ontwikkelde was hafnium nog niet bekend. In zijn werk voorspelde Mendeleev echter correct dat er een element zou bestaan waarvan de eigenschappen vergelijkbaar zijn met zirkonium en titanium maar dat wel zwaarder zou zijn.
In 1911 dacht de Franse chemicus Georges Urbain dat hij eindelijk het missende element 72 had gevonden. Hij noemde het “celtium”. Enkele jaren na zijn ontdekking bleek dat hij eigenlijk een combinatie van al ontdekte lanthanides had gevonden (de 15 elementen met de atoomnummer 57 tot en met 71 in het periodiek systeem. Urbain had wel al eerder het element lutetium gevonden.
Het was nog steeds onduidelijk of het ontbrekende element 72 een transitiemetaal of een zeldzaam aardmetaal zou zijn, het bevindt zich in het periodiek systeem namelijk op de grens van deze twee soorten elementen. De chemici die dachten dat het een zeldzaam aardmetaal zou zijn voerden vele vruchteloze zoektochten uit naar minerale die zeldzame aardmetalen bevatten.
Nieuw bewijs dat voortkwam uit de chemie als uit de natuurkunde ondersteunde echter het idee dat element 72 een transitiemetaal moest zijn. Wetenschappers wisten bijvoorbeeld dat element 72 onder titanium en zirkonium viel in het periodiek systeem en beiden zijn transitiemetalen. Bovendien voorspelde de Deense natuurkundige Niels Bohr, een van de grondleggers van de kwantumtheorie, dat element 72 een transitiemetaal zou zijn. Hij deed dit op basis van de elektronenconfiguratie van het element.
In 1921 moedigde Bohr de Hongaarse chemicus Georg von Hevesy en de Nederlandse natuurkundige Dirk Coster, destijds twee jonge onderzoekers in zijn instituut, aan om in zirkoniumerts te gaan zoeken naar element 72. Gebaseerd op zijn kwantumtheorie wist Bohr dat het nieuwe metaal een vergelijkbare chemische structuur zou hebben als zirkonium. De kans dat de beide elementen in dezelfde ertsen zouden voorkomen was dus erg groot.
Von Hevesey en Coster volgden het advies van Bohr op en gingen verder met het bestuderen van zirkoniumerts met behulp van röntgenspectroscopie. Ze gebruikten de theorie van Bohr over hoe elektronenschillen en subschillen in atomen worden gevuld om de verschillen tussen de röntgenspectra van de twee elementen te voorspellen. Deze methode leidde in 1923 uiteindelijk tot de ontdekking van hafnium. De ontdekking was een van de toen nog zes hiaten in het periodiek systeem. Ze vernoemden het nieuwe element naar de geboorteplaats van Bohr: Kopenhagen (Hafnia in het Latijn).
Toepassingen
Hafnium is opmerkelijk corrosiebestendig en een uitstekende absorbeur van neutronen. Het kan daardoor goed worden toegepast n nucleaire onderzeeërs en regelstaven voor kernreactoren. Regelstaven houden de kettingreactie van kernsplijting actief maar voorkomen ook dat deze oncontroleerbaar kan versnellen.
Hafnium wordt ook gebruikt in elektronische apparatuur zoals kathodes en condensatoren maar ook in keramiek, flitslampen voor fotografie en gloeilampen. Het wordt gebruikt in vacuümbuizen als een getter, een stof die combineert met en sporengassen uit buizen kan verwijderen. Hafnium wordt meestal gelegeerd met andere metalen zoals titanium, ijzer, niobium en tantaal. Hittebestendige hafnium-niobiumlegeringen worden bijvoorbeeld gebruikt in de ruimtevaart o.a. in raketmotoren.
Het samengestelde hafniumcarbide heeft het hoogste smeltpunt van alle verbindingen die uit slechts twee elementen bestaan, hierdoor kan het ook gebruikt worden voor het bekleden van ovens.
Weetjes
- In poedervorm is hafnium pyrofoor (ontbrandt spontaan).
- De Engelse chemicus Henry Moseley was degene die zich realiseerde dat het element “celtium” van Georges Urbain niet het echte element was dat zich onder zirkonium bevond. Helaas heeft de Eerste Wereldoorlog het belangrijke onderzoek van deze jonge wetenschapper onderbroken. Moseley meldde zich plichtsgetrouw aan bij de Royal Engineers van het Britse leger en werd in 1915 door een sluipschutter gedood. Zijn dood bracht Engeland ertoe een nieuw beleid vast te stellen dat prominente wetenschappers verbood deel te nemen aan de actieve strijd.
- In 1925 bedachten de Nederlandse chemici Anton Eduard van Arkel en Jan Hendrik de Boer een methode om zeer zuiver hafnium te produceren. Om dit te doen ontleedden de wetenschappers hafniumtetrajodide op een hete wolfraamdraad. Dit resulteerde n het kristalliseren van puur hafnium. Deze methode wordt het kristalstaafproces genoemd.
- Het nucleaire isomeer van hafnium is lang beschouwd als een potentieel wapen. Het isomeer kan gebruikt worden om een snelle afgifte van energie te bewerkstelligen.
- Ofschoon zirkonium sterk op hafnium lijkt is het in tegenstelling tot hafnium een slechte absorbeur van neutronen. Zirkonium wordt daarom in de buitenste laag van brandstofstaven gebruikt waar het belangrijk is dat neutronen gemakkelijk kunnen reizen.
Aardlagen dateren met behulp van hafnium
In een recente studie kon een internationaal team van wetenschappers bevestigen dat de eerste aardkorst ongeveer 4,5 miljard jaar geleden werd gevormd. Ze deden dit aan de hand van hun chemische analyse van hafnium in een zeldzame meteoriet. De onderzoekers geloven dat de meteoriet afkomstig is van de planetoïde Vesta die na een grote inslag rotsfragmenten richting de Aarde heeft gestuurd.
Volgens de onderzoekers zijn meteorieten stukjes van de originele materialen waaruit alle planeten zijn ontstaan. Voor hun onderzoek keken ze naar de verhouding 176Hf en 177Hf in de meteoriet. Dit gaf hen een startpunt voor de samenstelling van de Aarde. Ze vergeleken de resultaten met de oudste rotsen op Aarde en hiermee bewezen ze dat er 4,5 miljard jaar geleden al een korst aanwezig was op onze planeet. Hun bevindingen werden gepubliceerd in de Proceedings of the National Academy of Sciences (PNAS).