Barium
Inhoudsopgave
Barium is een relatief dicht en reactief aardalkalimetaal. Het is vernoemd naar het Griekse woord “barys”, dat “zwaar” betekent. Het wordt alleen van nature aangetroffen in combinatie met andere elementen en verbindingen die barium bevatten. Bariumverbindingen hebben een breed scala aan toepassingen. Ze worden aangetroffen in rattengif, verzwaringsmiddelen in olieboorvloeistoffen en in een bariumklysma. Dit is de witte vloeistof die wordt gebruikt om darmen te visualiseren in een diagnostische röntgenonderzoekstest.
Chemische gegevens
| Symbool | Ba |
| Volledige naam | Barium |
| Atoomnummer | 56 |
| Atoommassa (g.mol-1 ) | 137,33 |
| Groep | aardalkalimetaal |
| Elektronegativiteit (Pauling) | 0,89 |
| Dichtheid (g.cm-3 bij 20 °C) | 3,51 |
| Smeltpunt (°C) | 727 |
| Kookpunt (°C) | 1897 |
| Vanderwaalsstraal (nm) | 0,268 |
| Ionstraal | — |
| Isotopen | 7 natuurlijke isotopen waarvan 138 Ba de hoogste abundantie heeft |
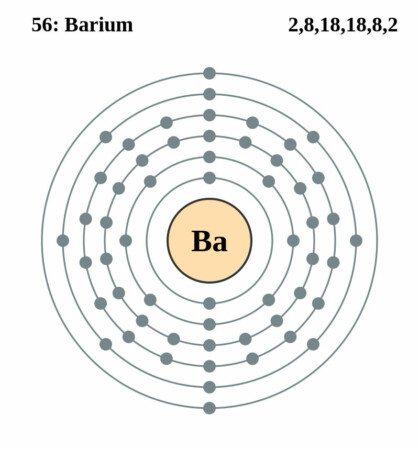
| Elektronenschil | [Xe]6s2 |
| Elektronen per schil | 2, 8, 18, 18, 8, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 502,9 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 965,2 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3600 |
| Standaard potentiaal (V) | -2,90 |
| Ontdekt door: | 1772 ontdekt door Carl Scheele en in 1808 geïsoleerd door Humphry Davy |
De ontdekking van Barium
De eerste aanwijzingen voor het bestaan van barium zijn afkomstig van de 17de eeuwse Italiaanse alchemist Vincenzo Casciarolo. Hij merkte barium op in de vorm van ongewone kiezelstenen die jarenlang na blootstelling aan hitte bleven gloeien. Hij noemde de stenen” naar zijn geboorteplaats “Bologna stenen”. Later ontdekte men dat het om bariumsulfaat ging (BaSO4). Aan het einde van de 18de eeuw ontdekten de Duitse chemicus Carl Scheele en de Engelse chemicus William Withering het bestaan van bariumoxide (BaO) respectievelijk bariumcarbonaat (BaCO3).
Zuiver barium werd in 1808 geïsoleerd en geïdentificeerd. Het was de Engelse chemicus Sir Humphry Davy die door middel van elektrolyse barium extraheerde uit gesmolten bariumzouten als bariumhydroxide Ba(OH)2. Bij elektrolyse wordt er een elektrische stroom door een ionische substantie geleid om ionen van elkaar te scheiden. Omdat de bariumzouten waren gesmolten konden de positieve bariumionen gemakkelijker naar het vat met de negatieve elektrode worden verplaatst en de andere negatieve ionen werden naar het vat met de positieve elektrode verplaatst.
Bohr – Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 56 | Barium | 130 Ba | 129,906310 | 0,106 |
| 132 Ba | 131,905056 | 0,101 | ||
| 134 Ba | 133,904503 | 2,417 | ||
| 135 Ba | 134,905683 | 6,592 | ||
| 136 Ba | 135,904570 | 7,854 | ||
| 137 Ba | 136,905821 | 11,232 | ||
| 138 Ba | 137,905241 | 71,698 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 114Ba | 113,95068 | 530 ms |
| 115Ba | 114,94737 | 0,45 s |
| 116Ba | 115,94138 | 1,3 s |
| 118Ba | 117,93304 | 5,2 s |
| 119Ba | 118,93066 | 5,4 s |
| 120Ba | 119,92604 | 24 s |
| 121Ba | 120,92405 | 29,7 s |
| 122Ba | 121,91990 | 1,95 min |
| 123Ba | 122,91878 | 2,7 min |
| 124Ba | 123,91509 | 11,0 min |
| 125Ba | 124,91447 | 3,5 min |
| 126Ba | 125,91125 | 100 min |
| 127Ba | 126,91109 | 12,7 min |
| 128Ba | 127,90831 | 2,43 d |
| 129Ba | 128,90867 | 2,23 uur |
| 130Ba | 129,90632 | 7 * 1013 jaar |
| 131Ba | 130,90694 | 11,50 d |
| 133Ba | 132,90600 | 10,51 jaar |
| 139Ba | 138,90884 | 83,06 min |
| 140Ba | 139,91060 | 12,752 dagen |
| 141Ba | 140,91441 | 18,27 min |
| 142Ba | 141,91645 | 10,6 min |
| 143Ba | 142,92062 | 14,5 s |
| 144Ba | 143,92295 | 11,5 s |
| 145Ba | 144,92763 | 4,31 s |
| 146Ba | 145,93022 | 2,22 s |
| 147Ba | 146,93495 | 0,893 s |
| 148Ba | 147,93772 | 0,612 s |
| 149Ba | 148,94258 | 344 ms |
| 150Ba | 149,94568 | 300 ms |
| 151Ba | 150,95081 | 200 ms |
| 152Ba | 151,95427 | 100 ms |
| 153Ba | 152,95961 | 80 ms |
Bronnen van Barium
Vanwege zijn hoge reactiviteit komt barium alleen voor in combinatie met andere elementen. Barium wordt meestal aangetroffen in combinatie met sulfaat en carbonaat maar het kan ook verbindingen vormen met hydroxide, chloride, nitraat, chloraat en andere negatieve ionen. Ongeveer 0,05% van de aardkorst is barium en het is daarmee in voorkomen het 17de element.
Mijnreserves in het Verenigd Koninkrijk, Italië, Tsjechië, Duitsland en de Verenigde Staten bevatten meer dan 400 miljoen ton barium.
Om puur barium te verkrijgen moet het worden gescheiden van andere elementen die aanwezig zijn in natuurlijk voorkomende bariumverbindingen. Barium kan door middel van elektrolyse uit bariumchloride worden gewonnen. Barium kan ook worden verkregen door bariumoxide bij hoge temperatuur en lage druk vacuüm te reduceren met behulp van aluminium of silicium.
Eigenschappen van Barium
Zuiver barium is een zacht, zilverachtig metaal. Het is als een aardalkalimetaal geclassificeerd. Elk atoom bevat twee valentie elektronen (de elektronen in de buitenste schil). Barium bevindt zich in periode 5 dus de valentie elektronen bevinden zich in de 5de schil. Deze elektronen worden gemakkelijk afgegeven waardoor barium gemakkelijk geoxideerd kan worden. Dit zorgt voor de hoge mate van reactiviteit van barium en dan in het bijzonder met elektronegatieve elementen zoals Zuurstof.
Toepassingen van Barium
Vanwege zijn hoge reactiviteit zijn er weinig praktische toepassingen van zuiver barium. Door zijn sterke aantrekkingskracht op zuurstof is het echter wel nuttig als “vangstof” om de laatste sporen zuurstof uit vacuümbuizen te verwijderen. Zuiver barium kan ook gebruikt worden gecombineerd met andere metalen om legeringen te maken toe worden gebruikt om onderdelen van machines te maken zoals lagers en bougies voor verbrandingsmotoren. Omdat de bariumelektronen relatief los zitten zenden legeringen van barium bij verhitting gemakkelijk elektronen uit en verbeteren ze zo de efficiëntie van bougies.
Bariumverbindingen worden commercieel veel gebruikt. Bariumsulfaat (ook bariet genoemd) wordt gebruikt als pigment in printerpapier en verf. Ook wordt het gebruikt in boorvloeistoffen voor oliebronnen, de productie van glas en het maken van rubber. Bariumcarbonaat wordt gebruikt als rattengif en bariumchloraat zorgt voor groene kleuren in vuurwerk.
Barium in je lichaam
Barium komt o.a. voor in wortels, uien, bonen, ontbijtgranen en sla. Het lichaam van een gemiddelde volwassenen bevat ongeveer 22 milligram barium. Het bariumgehalte in tanden kan wetenschappers helpen bij het bepalen wanneer baby’s overschakelen van borstvoeding naar het eten van vast voedsel. Deze lage gehaltes barium hebben geen biologische rol en ze zijn niet schadelijk.
Grote hoeveelheden oplosbare bariumzouten zijn wel giftig en kunnen duidelijk zijn. Barium kan leiden tot braken, koliek, diarree, tremors en verlammingen. Er zijn een handvol moorden bekend die met barium zijn uitgevoerd. Ook zijn er patiënten overleden toen tijdens een bariumklysma oplosbaar bariumcarbonaat werd gebruikt in plaats van het gebruikelijke onoplosbare bariumsulfaat.
Artsen voeren bariumklysma’s uit om afwijkingen van de dikke darm en het rectum te visualiseren en te diagnosticeren. Tijdens die procedure wordt bariumsulfaat via het rectum ingedruppeld om de binnenwanden van de dikke darm te bedekken. Er wordt lucht toegevoegd om ervoor te zorgen dat de bariumcoating alle oppervlakte-afwijkingen vult. Vervolgens worden er röntgenfoto’s gemaakt om een afbeelding te krijgen van het onderste deel van het maagdarmkanaal. Bariumsulfaat absorbeert röntgenstraling en ziet er op een röntgenfilm wit uit. De toegediende lucht en het omringende weefsel zijn zwart op de opname. Analyse van het röntgenbeeld van het bariumklysma stelt artsen in staat om aandoeningen als colitis ulcerosa, de ziekte van Crohn, poliepen, kanker en het prikkelbare darmsyndroom te diagnosticeren.