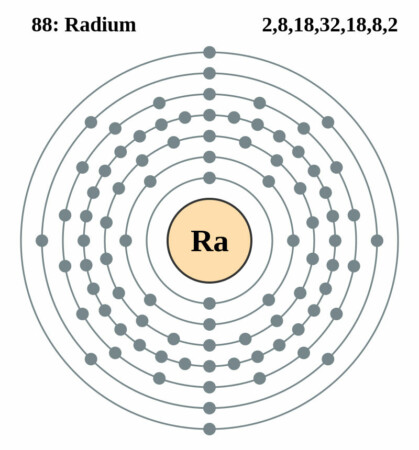
Radium
Inhoudsopgave
Radium is een zeer radioactief element en kan buitengewoon gevaarlijk zijn. Het werd echter ooit in veel alledaagse producten gebruikt waaronder polshorloges en tandpasta. Men dacht dat het genezende eigenschappen had totdat werd vastgesteld dat de intense radioactiviteit nadelige gezondheidseffecten veroorzaakte.
Ongeveer 1 ppt van de aardkorst bestaat uit radium. Sporen radium komen voor in uraniumertsen en dat komt omdat het een vervalproduct van uranium is. Er zijn verschillende bekende isotopen van radium maar vanwege de snelle vervaltijd van veel isotopen zijn de natuurlijke abundanties van de radiumisotopen onzeker.
Chemische gegevens
| Symbool | Ra |
| Volledige naam | Radium |
| Atoomnummer | 88 |
| Atoommassa (g.mol-1 ) | 226,0254 |
| Groep | aardalkali metaal |
| Elektronegativiteit (Pauling) | 0,9 |
| Dichtheid (g.cm-3 bij 20 °C) | 5,5 |
| Smeltpunt (°C) | 700 |
| Kookpunt (°C) | 1737 |
| Vanderwaalsstraal (nm) | 0,283 |
| Ionstraal (nm) | — |
| Isotopen | — |
| Elektronenschil | [Rn]7s2 |
| Elektronen per schil | 2, 8, 18, 32, 18, 2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 509,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 979,0 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | — |
| Standaard potentiaal (V) | — |
| Ontdekt door: | 1898 door Marie en Pierre Curie |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 88 | Radium | 223Ra | 223,018502 | * |
| 224Ra | 224,020212 | * | ||
| 226Ra | 226,025403 | * | ||
| 228Ra | 228,031071 | * |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 202Ra | 202,00989 | 2,6 ms |
| 203Ra | 203,00927 | 4 ms |
| 204Ra | 204,00650 | 60 ms |
| 205Ra | 205,00627 | 220 ms |
| 206Ra | 206,00382 | 0,24 s |
| 207Ra | 207,00380 | 1,3 s |
| 208Ra | 208,00184 | 1,3 s |
| 209Ra | 209,00199 | 4,6 s |
| 210Ra | 210,00049 | 3,7 s |
| 211Ra | 211,00089 | 13 s |
| 212Ra | 211,99979 | 13,0 s |
| 213Ra | 213,00038 | 2,74 min |
| 214Ra | 214,00010 | 2,46 s |
| 215Ra | 215,00272 | 1,55 ms |
| 216Ra | 216,00353 | 182 ns |
| 217Ra | 217,00632 | 1,63 µs |
| 218Ra | 218,00714 | 25,2 µs |
| 219Ra | 219,01008 | 10 ms |
| 220Ra | 220,01102 | 17,9 ms |
| 221Ra | 221,01391 | 28 s |
| 222Ra | 222,01537 | 38,0 s |
| 223Ra | 223,01850 | 11,43 dagen |
| 224Ra | 224,02021 | 3,6319 dagen |
| 225Ra | 225,02361 | 14,9 dagen |
| 226Ra | 226,02540 | 1600 jaar |
| 227Ra | 227,02917 | 42,2 min |
| 228Ra | 228,03107 | 5,75 jaar |
| 229Ra | 229,03495 | 4,0 min |
| 230Ra | 230,03705 | 93 min |
| 231Ra | 231,04122 | 103 s |
| 232Ra | 232,04364 | 250 s |
| 233Ra | 233,04806 | 30 s |
| 234Ra | 234,05070 | 30 s |
Bohr – Rutherford diagram
Geschiedenis
Radium is in 1898 door Marie en Pierre Curie ontdekt. Ze bestudeerden een uraniumerts uit Bohemen (het huidige Tsjechië) en toen het uranium uit het erts was verwijderd en de resten bleken nog steeds radioactief te zijn. De radioactieve resten werden vervolgens afgescheiden en bij bestudering van het spectrum bleek het materiaal voornamelijk barium met een onbekend element te zijn.
Vanwege de straling van het nieuwe element die ongeveer 3 miljoen maal groter was dan de straling van uranium werd het element vernoemd naar het Latijnse woord radius of straal. Uit ongeveer 10 ton uraniumerts haalden de Curies ongeveer 1 milligram radium.
In 1902 isoleerden Marie Curie en de Franse chemicus Andre Debierne voor het eerst radium, ze deden dit met behulp van elektrolyse. Radium E, later bekend als 210Bi, was het eerste synthetische radioactieve element dat werd gemaakt.
Weetjes
- Radium is het zwaarste aardalkali elementen. Beryllium, magnesium, calcium, strontium en barium zijn de overige aardalkali elementen.
- De korst van de Aarde bevat ongeveer 1 ppt radium. Hiermee is radium het 84ste element in de korst van de Aarde.
- Als radium aan lucht wordt blootgesteld dan verandert, als gevolg van oxidatie, de zilverwitte kleur in zwart.
- Radium-226 is het langstlevende radioisotoop. Het heeft een halfwaardetijd van 1062 jaar.
- Radium kan in het lichaam komen door inslikken en inademing. De gezondheidseffecten van radium omvatten o.a. kanker, bloedarmoede, staar en de dood.
- Radium straalt alfadeeltjes uit (twee protonen en twee neutronen tezamen), bèta deeltjes (hoogenergetisch elektronen oftewel positronen) en gammastraling (de meest energetische golflengte van licht).
- Radium bevindt zich in dezelfde groep als calcium en wordt soms gebruikt voor het opsporen van botkanker. Alfadeeltjes die door radium worden uitgezonden kunnen kankercellen vernietigen.
- Radium wordt voornamelijk gewonnen als bijproduct bij de winning van uranium. Het meest radium is afkomstig uit de uraniummijnen van Canada en de Democratische Republiek Congo.
- Radium wordt nog op ongeveer dezelfde manier uit uraniumerts gewonnen als marie en Pierre Curie dat deden aan het einde van de 19de eeuw.
- Radium werd gebruikt in klokken om de nummers en de cijfers te verven zodat ze zichtbaar waren in het donker. Tegenwoordig wordt radium hier niet meer voor gebruikt.
- Radium reageert met bijna alle niet-metalen waaronder zuurstof, fluor, chloor en stikstof.
- Een curie (Ci) is een eenheid die is genoemd naar de hoeveelheid straling die wordt uitgezonden door een hoeveelheid radionucliden die gelijk is aan 1 gram radium, of met een vervalsnelheid van 37 miljard desintegraties per seconde.
- Omdat radium in kleine hoeveelheden voorkomt in de omgeving worden we constant blootgesteld aan kleine hoeveelheden straling. Er is echter geen bewijs dat deze stralingsniveaus van radium schadelijk zijn.
- De aantekeningen van Marie en Pierre Curie zijn vanwege hun werk met radium nog steeds te radioactief.
- Vanwege haar werk met radium werd Marie Curie de eerste vrouw die een Nobelprijs voor de Natuurkunde won (1903) en de eerste wetenschapper die twee Nobelprijzen won (1911).
- Radium wordt gebruikt om radongas te produceren. Radon wordt gebruikt bij de behandeling van sommige vormen van kanker.
- Radium is een instabiel element en het vervalt verschillende malen om uiteindelijk als lood te eindigen.
Huidig onderzoek
Radium wordt vaak gebruikt om verschillende vormen van kanker te behandelen waaronder vooral botkanker en botmetastasen veroorzaakt door borstkanker.