Gallium
Inhoudsopgave
Gallium is een zacht, zilverkleurig metaal dat voornamelijk in elektronische circuits, halfgeleiders en LED’s wordt gebruikt. Het is ook nuttig in thermometers die hoge temperaturen moeten meten, barometers, farmaceutische producten en nucleaire medicijnen. Het element heeft geen bekende biologische waarde.
Natuurlijk element
In de natuur wordt gallium nooit in vrije vorm aangetroffen. Ook komt het niet in substantiële hoeveelheden voor in mineralen. Het komt in kleine hoeveelheden voor in verschillende verbindingen waaronder zinkertsen en bauxiet. Ongeveer 0,0019% van de aardkorst bestaat uit gallium. Het is door middel van smelten gemakkelijk te verkrijgen. Het meeste gallium wordt als bijproduct gewonnen bij de zink- en aluminiumproductie. Australië, Rusland, Frankrijk en Duitsland zijn de grootste producten van gallium.
Chemische gegevens
| Symbool | Ga |
| Volledige naam | Gallium |
| Atoomnummer | 31 |
| Atoommassa (g.mol-1 ) | 69,723 |
| Groep | post-transitiemetalen |
| Elektronegativiteit (Pauling) | 1,81 |
| Dichtheid (g.cm-3 bij 20 °C) | 5,91 |
| Smeltpunt (°C) | 29,8 |
| Kookpunt (°C) | 2400 |
| Vanderwaalsstraal (nm) | 0,187 |
| Ionstraal (nm) | — |
| Isotopen | 24 waarvan 2 stabiel: 69 Ga en 71 Ga |
| Elektronenschil | [Ar]3d104s24p1 |
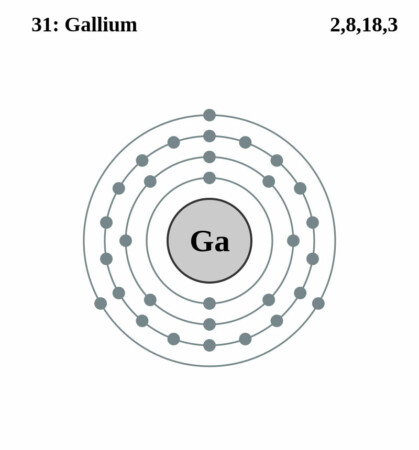
| Elektronen per schil | 2, 8, 18, 3 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 578,8 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1979,3 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 2963 |
| Standaard potentiaal (V) | — |
| Ontdekt door: | voorspeld: Dmitri Mendeleev (1871), ontdekt: 1875: Lecoq de Boisbaudran |
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 31 | Gallium | 69 Ga | 68,925581 | 60,108 |
| 71 Ga | 70,924705 | 39,892 |
Radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 60Ga | 59,95706 | 70 ms |
| 61Ga | 60,94945 | 168 ms |
| 62Ga | 61,94417 | 116,18 ms |
| 63Ga | 62,93929 | 32,4 s |
| 64Ga | 63,93683 | 2,627 min |
| 65Ga | 64,93273 | 15,2 min |
| 66Ga | 65,93158 | 9,49 uur |
| 67Ga | 66,92820 | 3,2612 dagen |
| 68Ga | 67,92798 | 67,71 min |
| 70Ga | 69,92602 | 21,14 min |
| 72Ga | 71,92636 | 14,095 uur |
| 73Ga | 72,92517 | 4,86 uur |
| 74Ga | 73,92694 | 8,12 min |
| 75Ga | 74,92650 | 126 s |
| 76Ga | 75,92882 | 32,6 s |
| 77Ga | 76,92915 | 13,2 s |
| 78Ga | 77,93160 | 5,09 s |
| 79Ga | 78,93289 | 2,847 s |
| 80Ga | 79,93652 | 1,697 s |
| 81Ga | 80,93775 | 1,217 s |
| 82Ga | 81,94299 | 0,599 s |
| 83Ga | 82,94698 | 308 ms |
| 84Ga | 83,95265 | 0,085 s |
| 85Ga | 84,95700 | 50 ms |
| 86Ga | 85,96312 | 30 ms |
Een uniek metaal
In het periodiek systeem der elementen bevindt Gallium zich in groep 13, de boot-familie. In deze groep bevinden zich boor (B) en de metalen Aluminium (Al), Indium (In) en Thallium (Tl). Deze vijf elementen hebben drie elektronen in hun buitenste schil.
Gallium is een post-transitiemetaal. Deze metallische elementen bevinden zich tussen de transitie metalen en de metalloïden. Post-transitiemetalen hebben enkele eigenschappen van de transitiemetalen maar ze zijn zachter en het zijn slechtere geleiders. De post-transitiemetalen omvatten enkele elementen van de boor-familie (Al, In en Tl) maar ook Tin (Sn), Lood (Pb) en Bismut (Bi).
Gallium heeft enkele unieke eigenschappen. Zo is het bij kamertemperatuur vast maar nog wel zo zacht dat je het met een mes kan snijden. Het heeft een smeltpunt van 29,6 °C, minder dan 10 °C boven kamertemperatuur, dus als je een stukje gallium oppakt smelt het door de warmte van je hand. Als je het loslaat wordt het al weer snel een vaste stof.
Zelfs met een dergelijk laag smeltpunt heeft gallium een hoog kookpunt van 2204 °C. Hiermee heeft gallium een van de grootste verschillen tussen smeltpunt en kookpunt van alle elementen. Bij lage temperaturen is gallium een brosse vaste stof die gemakkelijk breekt. En vergelijkbaar met glas versplinterd het.
Toepassingen van Gallium
Gallium wordt voornamelijk in elektronica gebruikt. Ongeveer 95% van alle geproduceerde gallium wordt gebruikt om er galliumarsenide (GaAs) van te maken. Dit is een verbinding die wordt gebruikt in microgolf- en infraroodcircuits, halfgeleiders en blauwe en violette LED’s. Galliumarsenide van rechtstreeks uit elektriciteit laserlicht produceren en het wordt gebruikt in zonnepanelen. De verbinding galliumnitride (GaN) wordt gebruikt als halfgeleider in blue-ray-technologie, mobiele telefoons en druksensoren voor aanraakschakelaars.
Gallium bindt gemakkelijk met de meeste metalen en het wordt vaak gebruikt om er laagsmeltende legeringen mee te maken. Het is een van de vier metalen (waaronder kwik, rubidium en cesium) die vloeibaar zijn bij of nabij kamertemperatuur. Van deze vier metalen is gallium het minst reactief en het minst giftig. Het is daardoor de meest veilige en milieuvriendelijke keuze voor hoge-temperatuur thermometers, barometers, warmteoverdrachtsystemen en koel- en verwarmingsapparatuur.
Het kan echter behoorlijk moeilijk zijn om met vloeibaar gallium te werken. Het hecht namelijk aan glas, de huid en de meeste andere metalen (met uitzondering van kwarts, teflon en grafiet). Het zet uit als het vriest en dit betekent dat je het niet in glazen potten kan bewaren.
Gallium wordt ook gebruikt in bepaalde geneesmiddelen en radiofarmaca. Het radioactieve isotoop 67Ga wordt bijvoorbeeld gebruikt in de nucleaire medische diagnostiek voor het opsporen van ontstekingen of kanker in het lichaam.
Galliumnitraat wordt in veel geneesmiddelen gebruikt en als behandeling tegen hypercalciëmie. Dit is een ziekte die kan tijdens tot de groei van bottumoren. Gallium is ook voorgesteld voor de behandeling van kanker, infectieziektes en ontstekingsziektes. Blootstelling aan grote hoeveelheden gallium kan echter leiden tot irritatie van keel en borst en de dampen kunnen leiden tot ernstige aandoeningen.
Ontdekking
Voordat gallium werd ontdekt was het al voorspeld door de Russische chemicus en uitvinder Dmitri Mendeleev. Hij stelde ook het periodiek systeem op. Mendeleev noemde het ontbrekende element eka-aluminium omdat hij wist dat het volgens het periodiek systeem onder aluminium zou staan.
In 1875 was het de Franse chemicus Paul-Émile Lecoq de Boisbaudran die als eerste het element ontdekte. Hij bestudeerde gedurende 15 jaar de spectra van chemische elementen. Omdat ieder element zijn eigen set lijnen produceert is dit een betrouwbare manier om elementen te identificeren.
Lecoq de Boisboudran vroeg zich af of element 31 wellicht gevonden kon worden in zinkertsen. Zink heeft atoomnummer 30 en bevindt zich dus naast gallium in het periodiek systeem. In augustus 1875 vond Lecoq de Boisbaudran met behulp van een spectroscoop inderdaad wat gallium maar slechts in zeer kleine hoeveelheden. Hij meldde dat het spectrum van het nieuwe element was samengesteld uit een smalle, gemakkelijk zichtbare, violette straal.
Later in dat jaar slaagde Lecoq de Boisbaudran er in om door middel van elektrolyse gallium te verkrijgen. Lecoq de Boisboudran verkreeg vervolgens van mijnwerkers enkele tonnen zinkerts voor zijn onderzoek. Uit dit erts kon hij een paar gram bijna puur gallium produceren. Lecoq de Boisbaudran stelde de naam Gallium voor naar het Latijnse woord “Gallia” dat Frankrijk betekent.
Weetjes
- Vloeibaar gallium zet bij bevriezen 3,1% uit. Het kan daarom niet bewaard worden in glazen of metalen containers.
- Van alle metalen heeft gallium het grootste vloeistofbereik.
- Het Neutrino Observatory in Italië gebruikt grote hoeveelheden galliumtrichloride voor het bestuderen van neutrino’s van de Zon. Neutrino’s zijn deeltjes die zijn gemaakt in de eerste seconde van het heelal, zelfs vóór de eerste atomen ontstonden, en die voortdurend worden aangemaakt door kernfusiereacties in de Zon en andere sterren.
- In zijn zuiverste, geëxtraheerde vorm heeft gallium een heldere zilverachtige kleur. Als vaste stof is het blauw-grijs.
- Een andere ongebruikelijke eigenschap van gallium is dat het vrij gemakkelijk onderkoeld kan worden. Onderkoeling is het afkoelen van een stof tot onder het vriespunt zonder dat er een vaste stof van te maken.
- Ongeveer 95% van de geproduceerde gallium wordt in de elektronica industrie gebruikt. Galliumarsenide en galliumnitride zijn goed voor 98% van het galliumverbruik.
- Gallium is in atoombommen gebruikt om de kristalstructuur te stabiliseren. Als gallium op glas wordt geschilderd dan ontstaat er een glanzende spiegel.
- Het kookpunt van gallium bevindt zich, op absolute schaal, meer dan 8 keer boven het smeltpunt. Dit is de grootste verhouding tussen smeltpunt en kookpunt van elk ander element.