Polonium
Inhoudsopgave
Polonium is een zeer zeldzaam en zeer vluchtig radioactief metaal. Voordat de Frans-Poolse natuurkundige Marie Curie polonium in 1898 ontdekte waren uranium en thorium de enige bekende radioactieve elementen. Curie noemde polonium naar haar vaderland, Polen.
Polonium heeft weinig nut voor mensen maar er zijn enige uitzonderingen: het werd gebruikt als trigger in de eerste atoombom en het is ook vermoedelijk gebruikt als gif bij enkele spraakmakende sterfgevallen.
In commerciële toepassingen wordt polonium af en toe gebruikt om statische elektriciteit in machines of stof van fotografische films te verwijderen. Het kan ook worden gebruikt als lichtgewicht warmtebron voor thermo-elektrische energie in ruimtesondes.
Classificatie
Polonium bevindt zich in groep 16 en periode 6 van het periodiek systeem. Het wordt als een metaal geclassificeerd omdat de elektrische geleidbaarheid afneemt naarmate de temperatuur stijgt.
Het element is het zwaarste metaal van de chalcogenen. Dit is een groep elementen die ook wel de “zuurstoffamilie” wordt genoemd. Alle chalcogenen worden aangetroffen in koperertsen. Andere elementen in de chalcogenengroep zijn zuurstof, zwavel, seleen en telluur.
Er zijn 33 bekende isotopen (atomen van hetzelfde element met een verschillend aantal neutronen) van polonium en ze zijn allemaal radioactief. De radioactieve instabiliteit van dit element maakt het een geschikte kandidaat voor gebruik in atoombommen.
Chemische gegevens
| Symbool | Po |
| Volledige naam | Polonium |
| Atoomnummer | 84 |
| Atoommassa (g.mol-1 ) | 209 |
| Groep | Post transitiemetalen |
| Elektronegativiteit (Pauling) | 2,0 |
| Dichtheid (g.cm-3 bij 20 °C) | 9,196 |
| Smeltpunt (°C) | 254 |
| Kookpunt (°C) | 962 |
| Vanderwaalsstraal (nm) | 0,197 |
| Ionstraal (nm) | 0,102 (+4) |
| Isotopen | |
| Elektronenschil | [Xe]4f145d106s26p4 |
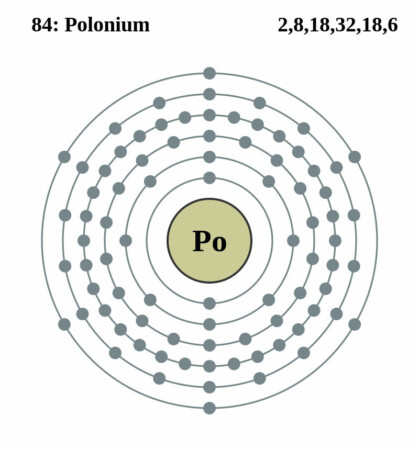
| Elektronen per schil | 2, 8, 32, 18, 6 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 812,1 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | |
| Standaard potentiaal (V) | |
| Ontdekt door: | 1898 door Pierre en Marie Curie, eerste isolatie in 1902 door Willy Marckwald |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 84 | Polonium | 209 Po | 208,982416 | * |
| 210 Po | 209,982874 | * |
Radioisotopen van Polonium
| Nuclide | Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
| 189Po | 188,998481 | 5 ms |
| 190Po | 189,995101 | 2,46 ms |
| 191Po | 190,994574 | 22 ms |
| 192Po | 191,991335 | 32,2 ms |
| 193Po | 192,99103 | 420 ms |
| 194Po | 193,988186 | 0,392 s |
| 195Po | 194,98811 | 4,64 s |
| 196Po | 195,985535 | 5,56 s |
| 197Po | 196,98566 | 53,6 s |
| 198Po | 197,983389 | 1,77 min |
| 199Po | 198,983666 | 5,48 min |
| 200Po | 199,981799 | 11,5 min |
| 201Po | 200,982260 | 15,3 min |
| 202Po | 201,980758 | 44,7 min |
| 203Po | 202,981420 | 36,7 min |
| 204Po | 203,980318 | 3,53 uur |
| 205Po | 204,981203 | 1,66 uur |
| 206Po | 205,980481 | 8,8 dagen |
| 207Po | 206,981593 | 5,80 uur |
| 208Po | 207,9812457 | 2,898 jaar |
| 209Po | 208,9824304 | 124 jaar |
| 210Po | 209,9828737 | 138,376 dagen |
| 211Po | 210,9866532 | 0,516 s |
| 212Po | 211,9888680 | 299 ns |
| 215Po | 214,9994200 | 1,781 ms |
| 216Po | 216,0019150 | 0,145 s |
| 217Po | 217,006335 | 1,47 s |
| 218Po | 218,0089730 | 3,10 min |
| 219Po | 219,01374 | 2 min |
| 220Po | 220,01660 | 40 s |
Bohr – Rutherford diagram
Creative Commons Attribution-Share Alike 2.0 uk. CC BY-SA 2.0 uk
Ontdekking
Toen Curie en haar man Pierre Curie het element polonium ontdekten waren ze op zoek naar de bron van radioactiviteit on een natuurlijk voorkomend uraniumrijk erts dat uraniniet wordt genoemd.
De twee merkten op dat ongeraffineerd uraniniet radioactiever was dan het uranium dat ervan was afgescheiden. Dus redeneerden ze dat uraniniet minstens één ander radioactief element moest bevatten.
De Curies kochten grote hoeveelheden uraniniet zodat ze de verbindingen in de mineralen chemisch konden scheiden. Na maanden van nauwgezet werk isoleerden ze eindelijk het radioactieve element: een stof die 400 keer radioactiever is dan uranium.
Het extraheren van polonium was een uitdaging omdat er zo’n minuscule hoeveelheid aanwezig was: 1 ton uraniumerts bevat slechts ongeveer 100 microgram (0,0001 gram) polonium.
Desalniettemin waren de Curies in staat om het isotoop dat we kunnen kennen als polonium-239 te isoleren.
Bronnen
Sporen van 210Po kunnen in de lucht en de grond worden gevonden. 201Po ontstaat bij het verval van 222Rn gas (radon gas) wat weer een vervalproduct is van radium. Radium is een vervalproduct van uranium en dat is aanwezig in nagenoeg alle gesteente en grond die uit rotsen is ontstaan.
Korstmossen kunnen polonium rechtstreeks uit de atmosfeer opnemen. In noordelijke gebieden kunnen mensen die rendieren eten hogere concentraties polonium in hun bloed hebben. Dit komt omdat rendieren korstmossen eten.
Polonium wordt als een zeldzaam natuurlijk element beschouwd. Hoewel het wordt aangetroffen in uraniumertsen is het niet economisch om het hieruit te extraheren. In 1 ton uraniumerts bevindt zich slechts ± 100 microgram polonium.
In plaats daarvan wordt polonium geproduceerd door in een kernreactor 209Bi (een stabiel isotoop) te beschieten met neutronen. Hierdoor ontstaan radioactief 210Bi dat vervalt tot polonium. Dit gebeurt via bètaverval.
Wereldwijd wordt er jaarlijks ongeveer 100 gram 210Po geproduceerd.
Commerciële toepassingen
Vanwege zijn hoge radioactiviteit heeft polonium weinig commerciële toepassingen. Enkele van de beperkte toepassingen van het element zijn het elimineren van statische elektriciteit in machines en het verwijderen van stof van fotografische films. Bij beide toepassingen moet het polonium zorgvuldig worden verzegeld om de gebruiker te beschermen.
Het element wordt ook gebruikt als lichtgewicht warmtebron voor thermo-elektrische energie in ruimtesondes en andere ruimtevaartuigen. Dat komt omdat polonium snel vervalt en daarbij een grote hoeveelheid energie vrijgeeft in de vorm van warmte. Als 1 gram polonium degradeert kan dat een temperatuur van 500 °Celsius opleveren.
Atoombom
In het midden van de Tweede Wereldoorlog werd er in de Verenigde Staten een geheim onderzoeks- en ontwikkelingsprogramma gestart dat uiteindelijk ’s werelds eerste kernwapens zou produceren.
Vóór de jaren ’40 was er geen reden om polonium in zijn pure vorm te isoleren of het in een substantiële hoeveelheid te produceren. Er waren geen toepassingen bekend en er was heel weinig bekend over de eigenschappen van polonium. Nadat men begon met het bestuderen van polonium ontdekte men dat het element een belangrijk ingrediënt voor kernwapens zou kunnen zijn.
Een combinatie van polonium en beryllium fungeerde als een soort van starter voor de eerste atoombommen.
Vergiftiging
Polonium is voor mensen giftig, zelfs in zeer kleine hoeveelheden.
De eerste persoon die aan een poloniumvergiftiging overleed was vermoedelijk Irène Joliot-Curie, de dochter van Marie Curie. In 1946 explodeerde een capsule polonium in haar laboratorium en dat zou de oorzaak kunnen zijn dat ze leukemie opliep en 10 jaar later stierf.
Polonium was ook de oorzaak van de dood van Alexander Litvinenko, een voormalig Russische spion, die in 2006 in Londen woonde nadat hij er politiek asiel had aangevraagd.
Vergiftiging werd ook vermoed bij de dood van de Palestijnse leider Yasser Arafat in 2004. Op zijn kleding werden verrassend hoge concentraties 210Po gevonden.
Een in 2011 gepubliceerde studie schrijft dat tabaksproducenten weten dat sigaretten en andere tabaksbevattende producten lage concentraties polonium bevatten. De auteurs van het artikel berekenden dat polonium in sigaretten verantwoordelijk is voor tot 138 doden per 1000 rokers over een periode van 25 jaar.
Ander onderzoek heeft aangetoond dat, vergeleken met niet-rokers, een dubbele hoeveelheid polonium is aangetroffen in ribben van rokers.