Lood
Inhoudsopgave
Lood is een ongelooflijk nuttig metaal maar het is ook giftig voor mensen. Als we ons geen zorgen hoefden te maken over het inademen van loodstof of het inslikken van loden deeltjes dan zou lood op grote schaal gebruikt worden vanwege zijn zeer industrievriendelijke eigenschappen zoals een uitstekende kneedbaarheid en corrosiebestendigheid.
Door de geschiedenis heen, voordat de wetenschappelijke vooruitgang van de 20ste eeuw de giftigheid van lood aan het licht bracht, werd lood veel gebruikt in een verscheidenheid aan producten waaronder cosmetica, verf, soldeer, leidingen en benzine. Bepaalde eigenschappen van lood, namelijk zijn taaiheid en weerstand tegen corrosie en kleine lekken maken het een bijzonder goed materiaal voor de aanleg van waterleidingen. Zelfs de oude Romeinen maakten hun waterleidingen van lood waardoor sommigen dachten dat loodvergiftiging, althans gedeeltelijk, leidde tot de val van het Romeinse rijk.
Natuurlijk element
Lood is een glanzend, blauwwit element dat slechts 0,0013% van de aardkorst uitmaakt. Het wordt echter niet als zeldzaam beschouwd omdat het wijdverspreid wordt gevonden en gemakkelijk is te extraheren. Lood komt meestal in zeer kleine hoeveelheden voor in ertsen zoals galena, anglesiet en cerussiet.
Het chemische symbool voor lood is Pb. Deze afkorting is afkomstig van het Latijnse woord “plumbum”, wat waterleiding betekent. Dit verwijst naar de oudheid toen het metaal op grote schaal werd gebruikt bij de constructie van waterleidingen. Hoewel er meer dan 27 loodisotopen zijn, zijn er slechts 5 stabiel.
Loden voeringen
Hoewel lood uit veel van zijn eerdere toepassingen is verwijderd is dit niet-corrosieve metaal eigenlijk hele nuttig in producten in aanraking komen met of corrosieve vloeistoffen zoals zwavelzuur bevatten. Zo wordt lood gebruikt om de binnenkant van tanks te bekleden. Ook wordt het toegepast in loodzuuraccu’s zoals die in auto’s worden gebruikt.
Vanwege zijn dichtheid en vermogen om trillingen te absorberen vormt lood ook een uitstekende bescherming tegen verschillende soorten schadelijke straling zoals in röntgenapparaten en kernreactoren. Lood wordt ook nog steeds gebruikt in sommige kogels en andere munitie.
Loodhoudende benzine
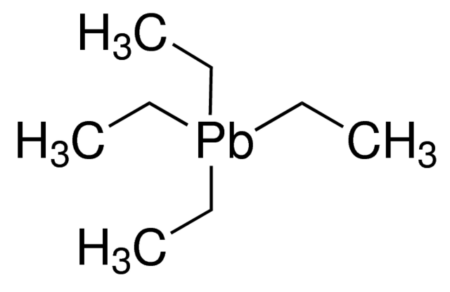
Vanaf de jaren ’20 van de vorige eeuw werd er tetra-ethyllood (C8H20Pb) toegevoegd aan benzine om het kloppen, slijtage en de voorontbranding van de motor te helpen verminderen. Dit lood kwam echter allemaal in het milieu terecht. Omstreeks 1990 begon de omschakeling naar loodvrije benzine. Dit was ook noodzakelijk door de ontwikkeling en invoering van katalysatoren in de uitlaatsystemen van auto’s, Lood is echter een katalysator gif en moest daarom worden verbannen. In eerste instantie werd benzeen toegevoegd maar dit is een zeer giftige stof. Tegenwoordig wordt MTBE (Methyl-Tertiaire ButylEther) toegevoegd als vervanger voor lood. Ook deze stof is niet onomstreden maar vooralsnog is er geen beter alternatief.
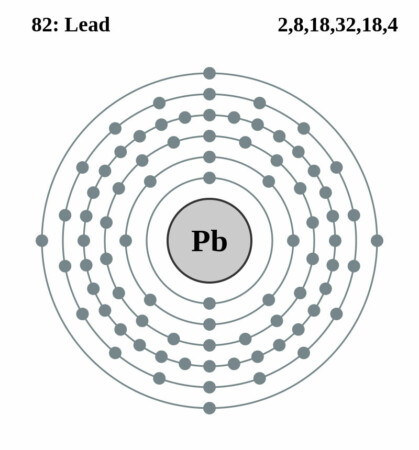
Bohr – Rutherford diagram
Chemische gegevens
| Symbool | Pb |
| Volledige naam | Lood |
| Atoomnummer | 82 |
| Atoommassa (g.mol-1 ) | 207,2 |
| Groep | post-transitiemetalen |
| Elektronegativiteit (Pauling) | 1,87 |
| Dichtheid (g.cm-3 bij 20 °C) | 11,342 |
| Smeltpunt (°C) | 327,46 |
| Kookpunt (°C) | 1749 |
| Vanderwaalsstraal (nm) | 0,202 |
| Ionstraal (nm) | 0,132 (+2), 0,084 (+4) |
| Isotopen | 4 stabiel |
| Elektronenschil | [Xe]4f145d106s26p2 |
| Elektronen per schil | 2, 8, 18, 32, 18, 4 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 715,6 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1450,5 |
| Derde ionisatiepotentiaal (kJ.mol-1 ) | 3081,5 |
| Standaardpotentiaal (V) | — |
| Ontdekt door: | ± 7000 v. Christus in het Midden-Oosten |
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 82 | Lood | 204 Pb | 203,973029 | 1,4 |
| 206 Pb | 205,974449 | 24,1 | ||
| 207 Pb | 206,975881 | 22,1 | ||
| 208 Pb | 207,976636 | 52,4 |
Radiosiotopen
|
Nuclide |
Isotopische massa (u) | Halfwaardetijd |
|---|---|---|
|
178Pb |
178,00383 |
0,23 ms |
|
179Pb |
179,00215 |
3 ms |
|
180Pb |
179,99791 |
4,5 ms |
|
181Pb |
180,99662 |
45 ms |
|
182Pb |
181,99267 |
60 ms |
|
183Pb |
182,99187 |
535 ms |
|
184Pb |
183,98814 |
490 ms |
|
185Pb |
184,98761 |
6,3 s |
|
186Pb |
185,98423 |
4,82 s |
|
187Pb |
186,98391 |
15,2 s |
|
188Pb |
187,98087 |
25,5 s |
|
189Pb |
188,98081 |
51 s |
|
190Pb |
189,97808 |
71 s |
|
191Pb |
190,97827 |
1,33 min |
|
192Pb |
191,97578 |
3,5 min |
|
193Pb |
192,97617 |
5 min |
|
194Pb |
193,97401 |
12,0 min |
|
195Pb |
194,97454 |
± 15 min |
|
196Pb |
195,97277 |
37 min |
|
197Pb |
196,97343 |
8,1 min |
|
198Pb |
197,97203 |
2,4 uur |
|
199Pb |
198,97291 |
90 min |
|
200Pb |
199,97182 |
21,5 uur |
|
201Pb |
200,97288 |
9,33 uur |
|
202Pb |
201,97215 |
52,5 * 103 jaar |
|
203Pb |
202,97339 |
51,873 uur |
|
205Pb |
204,97448 |
15,3 * 106 jaar |
|
209Pb |
208,98109 |
3,253 uur |
|
210Pb |
209,98418 |
22,20 jaar |
|
211Pb |
210,98873 |
36,1 min |
|
212Pb |
211,99189 |
10,64 uur |
|
213Pb |
212,99658 |
10,2 min |
|
214Pb |
213,99980 |
26,8 min |
|
215Pb |
215,00481 |
36 s |
Giftigheid
Voordat mensen de omvang van de giftigheid van lood inzagen werd het in heel vele producten verwerkt. Zo veel dat het vandaag de dag nog steeds een reëel gevaar voor de volksgezondheid vormt. Kinderen die in oudere huizen wonen kunnen bijvoorbeeld nog steeds lood inademen via stof of afbladderende schilfers van loodhoudende verf. Lood kan ook in de drinkwatervoorziening terechtkomen via oudere, gecorrodeerde loden leidingen, kranen en soldeer. Tegenwoordig is lood verboden maar nog lang niet alle oudere woningen in Nederland zijn gesaneerd.
De meeste gevallen van loodvergiftiging zijn te wijten aan chronische blootstelling aan lage doses. Aangezien de symptomen van een langzame loodvergiftiging voornamelijk emotioneel en mentaal van aard zijn, kan loodvergiftiging het laatste zijn waar aan wordt gedacht bij het stellen van een diagnose. Lood kan de lichamelijke en geestelijke ontwikkeling van baby’s en jonge kinderen vertragen. Bij volwassenen kan langzame ophoping van lood leiden tot schade aan de nieren en het zenuwstelsel, bloedarmoede, beroerte en kanker.
Weetjes
Potloden bevatten geen, en hebben dat ook nooit gedaan, lood. Het lood in potloden is eigenlijk grafiet. Toen in de 16de eeuw voor het eerst grote grafietafzettingen van grafiet werden gevonden in Engeland gingen mensen ervan uit dat ze lood hadden ontdekt, vandaar de naam.
In de oude alchemie werd lood beschouwd als de prima matera of oermaterie. Alchemisten associeerden lood met Saturnus, de Romeinse god van de landbouw en oogst. Dienovereenkomstig werd lood weergegeven met het symbool van Saturnus, de zeis ♄.
In het oude Rome werd lood door gewetenloze personen aan wijn toegevoegd in de perceptie van de zoetheid van de wijn te vergroten. Hoewel deze praktijk in 1498 ten strengste werd verboden was het de Rooms-katholieke kerk die nog geruime tijd doorging met deze praktijken. Dit leidde tot ver in de 18de eeuw tot grootschalige vergiftigingen.
In de 16de en 17de eeuwse Europa werd lood toegevoegd aan cosmetica om op die manier een frisse “blanke” tint te krijgen. Dat was in die tijd heel populair vooral onder de adel. Een beroemde gebruiker van loodmake-up was koningin Elisabeth I van Engeland. Helaas resulteerde langdurig contact met lood vaak in rotte tanden en ironisch genoeg werden ook tandvervangingen vaak gemaakt van lood waardoor de gezondheidsschade van de betreffende persoon alleen maar groter werd.