Lanthaan
Inhoudsopgave
Wat is Lanthanum?
Lanthaan heeft atoomnummer 27 en symbool La. Het is een kneedbaar en buigzaam zilverwit element dat in de lucht snel oxideert. Het behoort tot de lanthaniden en het wordt meestal gevonden samen met andere zeldzame aardmetalen zoals cerium. Lanthaan wordt geproduceerd uit de mineralen bastnasiet en monaziet.
Het element is in 1832 door Carl Mosander ontdekt toen hij ceriumnitraat verhitte en het zout behandelde met salpeterzuur. Mosander isoleerde een nieuw element uit de ontstane oplossing en noemde dit lantana. In 1932 werd lanthaan in zijn zuivere vorm geïsoleerd.
Gegevens
| Symbool | La |
| Volledige naam | Lanthaan – Lanthanum |
| Atoomnummer | 57 |
| Atoommassa (g.mol-1 ) | 138,9055 |
| Groep | Lanthaniden |
| Elektronegativiteit (Pauling) | 1,1 |
| Dichtheid (g.cm-3 bij 20 °C) | 6,18 |
| Smeltpunt (°C) | 920 |
| Kookpunt (°C) | 3464 |
| Vanderwaalstraal (nm) | 0,104 (+3) |
| Ionstraal (nm) | |
| Isotopen | 7 |
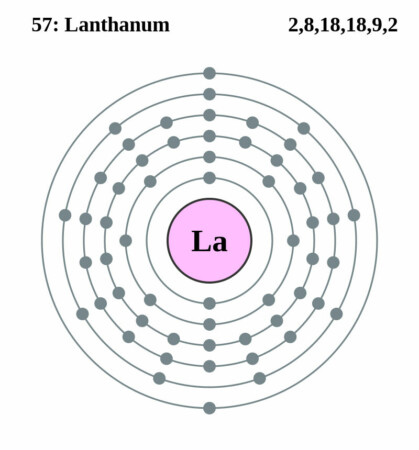
| Elektronenconfiguratie | [Xe]5d1 6s2 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 539 |
| Tweede ionisatie potentiaal (kJ.mol-1 ) | 1098 |
| Derder ionisatiepotentiaal (kJ.mol-1 ) | 1840 |
| Standaard potentiaal (V) | -2,52 (La+3 / La) |
| Ontdekt door | Carl Mosander in 1839 |
Lanthaan behoort tot de zeldzame aardmetalen maar dit betekent niet dat lanthaan zeldzaam is, het komt in grote hoeveelheden voor. Lanthaan wordt voornamelijk gewonnen uit bastaniet en monaziet. Er bevindt zich minder lanthaan in monaziet dan in bastnasiet. Die laatste was tot 1949 een zeldzaam mineraal dat niet als bron voor lanthaan werd beschouwd. Echter er werd een grote afzetting gevonden in Mountain Pass in de Verenigde Staten. Dit attendeerde wetenschappers op de aanwezigheid van carbonatiet, een mineraal dat zeldzame aarden bevat en een nieuwe klasse bleek te zijn van afzettingen van zeldzame aardmetalen. Kort hierna werden er ook dergelijke afzettingen gevonden in Afrika en in China.
Bohr-Rutherford diagram
Isotopen
| Nummer | Naam | Symbool | Atoommassa (u) | Abundantie (%) |
|---|---|---|---|---|
| 57 | Lanthaan | 138 La | 137,907107 | 0,090 |
| 139 La | 138,906348 | 99,910 |
radioisotopen
| Nuclide | Isotopische massa (u) | Halveringstijd |
|---|---|---|
| 117La | 116,95007 | 23,5 ms |
| 118La | 117,94673 | 200 ms |
| 119La | 118,94099 | 1 s |
| 120La | 119,93807 | 2,8 s |
| 121La | 120,93301 | 5,3 s |
| 122La | 121,93071 | 8,6 s |
| 123La | 122,92624 | 17 s |
| 124La | 123,92457 | 29,21 s |
| 125La | 124,92081 | 64,8 s |
| 126La | 125,91951 | 54 s |
| 127La | 126,91637 | 5,1 min |
| 128La | 127,91559 | 5,18 min |
| 129La | 128,91269 | 11,6 min |
| 130La | 129,91236 | 8,7 min |
| 131La | 130,91007 | 59 min |
| 132La | 131,91010 | 4,8 uur |
| 133La | 132,90822 | 3,912 uur |
| 134La | 133,90851 | 6,45 min |
| 135La | 134,90697 | 19,5 uur |
| 136La | 135,90764 | 9,87 min |
| 137La | 136,90649 | 6 × 104 jaar |
| 138La | 137,90711 | 1,02 × 1011 jaar |
| 140La | 139,90947 | 1,6781 dagen |
| 141La | 140,91096 | 3,92 uur |
| 142La | 141,91407 | 91,1 min |
| 143La | 142,91606 | 14,2 min |
| 144La | 143,91960 | 40,8 s |
| 145La | 144,92165 | 24,8 s |
| 146La | 145,92579 | 6,27 s |
| 147La | 146,92824 | 4,01 s |
| 148La | 147,93223 | 1,26 s |
| 149La | 148,93473 | 1,05 s |
| 150La | 149,93877 | 510 ms |
| 151La | 150,94172 | 300 ms |
| 152La | 151,94625 | 200 ms |
| 153La | 152,94962 | 150 ms |
| 154La | 153,95450 | 100 ms |
| 155La | 154,95835 | 60 ms |
Toepassingen
Wat commerciële toepassingen betreft wordt het element gebruikt om koolstofbooglampen te produceren voor projectorlampen en studiolicht in de filmindustrie.
Lanthaan wordt ook gebruikt bij de productie van speciale brillen en cameralenzen. Thuis vinden we lanthaan terug in huishoudelijke apparatuur zoals spaarlampen, fluorescentielampen, kleurentelevisies en brillen. Lanthaanoxide (La2 O2) wordt gebruikt bij de fabricage van optiek zoals telescoop- en cameralenzen en infrarood absorberend glas.
Als lanthaan in kleine hoeveelheden aan staal wordt toegevoegd dan verbetert het de vervormbaarheid. De zouten van lanthaan worden gebruikt bij de raffinage van aardolie en zeolietkatalysatoren omdat ze bij hoge temperaturen zeoliet kunnen stabiliseren.
Lanthaan wordt ook toegevoegd aan sponsachtige legeringen die tot 400 keer hun eigen volume aan waterstof op kunnen nemen als onderdeel van een omkeerbaar absorptieproces. Elke keer als dit gebeurt komt er warmte-energie vrij. Dit betekent dat dergelijke legeringen kunnen worden gebruikt in toepassingen voor energieomzetting. Verschillende lanthaanverbindingen, zoals chlorides, oxides en andere zeldzame aardmetalen worden gebruikt in diverse katalysatoren. Lanthaanoxide, toegevoegd aan wolfraam wordt gebruikt in elektrodes voor booglassen.
Het element komt zelden voor in de natuur en slechts in kleine hoeveelheden, hoewel het een van de meer voorkomende zeldzame aardmetalen is. In een werkomgeving kan lanthaan gevaarlijk zijn omdat dampen ingeademd kunnen worden. Langdurige blootstelling veroorzaakt longembolie. Bij mensen kan blootstelling aan lanthaan leiden tot kanker, vooral bij inademing. Grote hoeveelheden lanthaan in het lichaam vormen ene bedreiging voor de goede werking van de lever. Lanthaan wordt op verschillende plekken gebruikt, vooral in de petrochemische industrie. Weggegooide huishoudelijke apparatuur is een andere manier waarop lanthaan in het milieu terechtkomt. Het hoopt zich op in waterbodems en bodems, wat leidt dot hogere concentraties in bodemdeeltjes, dieren en mensen. Bij waterdieren veroorzaakt lanthaan schade aan de celmembranen. Dit beïnvloedt de werking van het zenuwstelsel en de voortplanting.