Indium
Inhoudsopgave
Ontdekking
Indium is in 1863 ontdekt door de Duitse chemicus Ferdinand Reich. Hij bestudeerde een zink mineraal waarvan hij dacht dat het misschien het pas ontdekte element thallium bevatte. Na het verhitten van het erts om alle zwavel te verwijderen gebruikte hij zoutzuur op het overgebleven materiaal. Hij zag toen een gelige vaste stof ontstaan. Hij vermoedde dat dit het sulfide van een nieuw element zou kunnen zijn maar omdat hij kleurenblind was vroeg hij aan zijn collega Hieronymous Richter om het spectrum te onderzoeken. Richter zag een heldere violet gekleurde lijn die niet overeenkwam met de spectraallijn van enig ander bekend element.
De twee werkten samen bij het isoleren van het nieuwe element en ze kondigden ook samen de ontdekking aan. De noemden het nieuwe element Indium, naar het Latijnse woord indicum. Dit betekent violet. Hun relatie liep echter op de klippen toen Reich hoorde dat Richter de ontdekking van het element voor zich opeiste.
| Symbool | In |
| Volledige naam | Indium |
| Atoomnummer | 49 |
| Atoommassa (g.mol-1 ) | 114,8 |
| Groep | Post-transitiemetaal |
| Elektronegativiteit (Pauling) | 1,78 |
| Dichtheid (g.cm-3 bij 20 °C) | 7,31 |
| Smeltpunt (°C) | 156,6 |
| Kookpunt (°C) | 2072 |
| Vanderwaalsstraal (nm) | 0,162 |
| Ionstraal (nm) | 0,092 (+2) |
| Isotopen | 3, waarvan 2 stabiel |
| Elektronenschil | [Kr]4d105s2 5p1 |
| Elektronen per schil | 2, 8, 18, 18, 3 |
| Eerste ionisatiepotentiaal (kJ.mol-1 ) | 558,3 |
| Tweede ionisatiepotentiaal (kJ.mol-1 ) | 1820,7 |
| Derde ionisatiepotentiaal (kJ.mol-1) | 2704 |
| Standaard potentiaal (V) | -0,34 (In3+/In) |
| Ontdekt door: | 1863 door Ferdinand Reich en Hieronymous Richter |
Toepassingen
Meer dan een eeuw na zijn ontdekking was het element nog steeds redelijk onbekend want niemand wist waarvoor het gebruikt kon worden. Tegenwoordig echter is indium essentieel voor de wereldeconomie en wel in de vorm van indiumtinoxide. Indiumtinoxide blijft het beste materiaal om aan de nog steeds groeiende behoefte aan LCD-schermen, televisieschermen en zonnepanelen te voldoen.
Indiumtinoxide heeft verschillende eigenschappen die het uitermate geschikt maken voor LCD’s en ander flat panels: het is transparant, geleid elektriciteit, hecht zeer goed aan glas, bestand tegen corrosie en het is chemisch en mechanisch stabiel.
Indiumtinoxide wordt ook gebruikt voor het maken van dunne coatings voor glas en spiegels. Een dunne coating van het materiaal over de ramen van vliegtuigen en auto’s zorgt ervoor dat ijs en mist gemakkelijker kan worden verwijderd. Bovendien verandert het de eisen voor airconditioning.
De groeiende vraag naar LCD’s heeft de prijs voor Indium de laatste jaren gestaag omhoog gestuwd.
Indium wordt tegenwoordig ook vaak gebruikt in legeringen en het wordt wel het metaalvitamine genoemd. Kleine hoeveelheden indium kunnen een drastisch verschil maken in een legering. Als er bijvoorbeeld een kleine hoeveelheid Indium wordt toegevoegd aan een legering van goud en platina dan wordt die legering veel harder. Indiumlegeringen worden ook toegepast om lagers van motoren die op hoge snelheid draaien en andere metaaloppervlaktes te coaten. Legeringen met Indium die een laag smeltpunt hebben komen voor in koppen van sprinklerinstallaties, schakelaars van branddeuren en smeltzekeringen.
Indium blijft bij erg lage temperaturen ongebruikelijk zacht en kneedbaar en dat maakt het perfect om te gebruiken in koude omstandigheden zoals cryogene pompen een hoog-vacuümsystemen. Een andere unieke eigenschap is zijn plakkerigheid waardoor het ook gebruikt kan worden in soldeermateriaal.
Indium wordt gebruik in verschillende elektrische apparaten zoals omvormers (apparaten die wisselstroom omzetten in gelijkstroom), thermistors (elektronische weerstanden die afhankelijk zijn van de temperatuur en fotogeleiders (apparaten die hun weerstand onder invloed van licht vergroten).
Bohr-Rutherford diagram
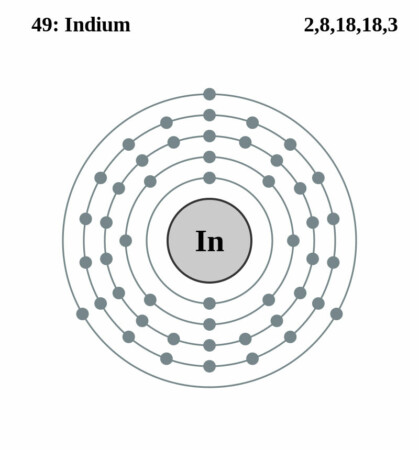
By Pumbaa (original work by Greg Robson) – Own work: (generated by script), CC BY-SA 2.0 uk,
Bronnen & hoeveelheden
Indium komt maar hoogste zelden vrij voor in de natuur. Het element wordt meestal gevonden in zink, ijzer, lood en koperertsen. Het is het 61ste element in de korst van de Aarde waar het ongeveer 3 keer meer voorkomt dan elementen als zilver en kwik. Men schat dat ongeveer 0,1 ppm van de korst van de Aarde bestaat uit indium. Op gewichtsbasis is dit ongeveer 250 ppb. Natuurlijk Indium is een mix van de isotopen 115I (95,72% en 113I (4,28%).
Het meeste indium wordt gewonnen in Canada, ongeveer 75 ton per jaar. De reservevoorraad indium wordt geschat op meer dan 1500 ton.
Weetjes
- Indiummetaal geeft een hoge “schreeuw” als het wordt gebogen. Dit is vergelijkbaar met de “schreeuw” van tin. De schreeuw lijkt op een krakend geluid.
- Indium is vergelijkbaar met glas omdat het gemakkelijk glas bevochtigt en het erg bruikbaar is voor het maken van laagsmeltende legeringen. Een legering bestaande op 24% indium en 76% gallium is bij kamertemperatuur vloeibaar.
- De eerste grootschalige toepassing van indium was in een coating voor lagers die in de Tweede Wereldoorlog in krachtige vliegtuigmotoren werden gebruikt.
Betere batterijen
Een coating van indium zou op een dag tot krachtigere en duurzamere oplaadbare lithiumbatterijen kunnen leiden. De indiumcoating zou een meer uniforme afzetting van lithium tijdens het opladen bieden en eventuele nevenreacties bufferen en de opslagcapaciteit vergroten.
Een lithium-ionbatterij is een type oplaadbare batterij die veel worden gebruikt in draagbare technologieën zoals mobiele telefoons en laptops. Tijdens het ontladen bewegen de lithiumionen van de negatieve elektrode (anode) naar de positieve elektrode (kathode). Terwijl de batterij wordt opgeladen reizen lithiumionen in de tegenovergestelde richting: de negatieve elektrode wordt kathode en de positieve elektrode wordt anode.
Momenteel gebruiken lithium-ionbatterijen anoden van grafiet die worden gebruikt om lithium op te slaan als de batterij is opgeladen. Een veelbelovend alternatief voor het gebruik van grafiet zijn metalen anodes, zoals lithiummetaal, die een veel grotere opslagcapaciteit zouden kunnen bieden. Een groot probleem bij het gebruik van metalen anodes is echter dat er een ongelijkmatige afzetting is van het metaal terwijl de batterij wordt opgeladen. Dit leidt tot de vorming van dendrieten (een kristalmassa met een vertakte boomachtige structuur). Na langdurig gebruik worden deze dendrieten zo groot dat ze de batterij kortsluiten.
Een ander probleem met metalen anodes is dat ze ongewenste nevenreacties veroorzaken tussen de reactieve metalen elektrodes en het elektrolyt (dit is het materiaal dat het mogelijk maakt dat elektriciteit tussen de anode en de kathode kan vloeien). Deze reacties kunnen de levensduur van een batterij significant verminderen.
Onderzoekers hebben een nieuw alternatief ontwikkeld: het coaten van lithium in een indiumzoutoplossing. De indiumlaag is uniform en zelf herstellend wanneer de elektrode in gebruik is. De chemische samenstelling blijft hetzelfde en het blijft intact tijdens laad-/ontlaadcycli waardoor nevenreacties worden voorkomen. Ook de vorming van dendrieten wordt voorkoen waardoor het oppervlak glad en compact blijft.